

| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
分析 (1)依据化合价升降法进行配平,结合电子守恒和原子守恒书写化学方程式;
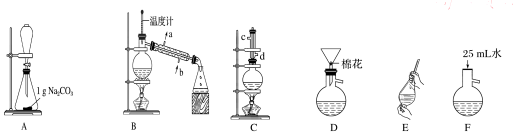
(2)①仪器名称为分液漏斗,仪器b中加入的是氢氧化钠固体或碱石灰,吸收水蒸气得到干燥的氨气;
②从发生装置中出来的氨气带有水蒸气,必须干燥,故B接D,D接A,吸收反应生成的水用装置D,最后空气中的水不能进入装置D,所以需要装置C;
③实验结束时应首先停止从a中滴加液体,没有必要有多余的氨气制备出;
④由MxOy~YH2O关系计算得到M的相对原子质量;
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶于没有发生变化,说明溶液中没有三价铁离子,反应后的固体成分可能为铁或是铁和氧化铁混合物,因为Fe+2Fe3+=3Fe2+.
解答 解:(1)依据反应前后原子守恒可知生成物缺项为生成的水,CuO+NH4Cl-Cu+CuCl2+N2↑+H2O,铜元素化合价+2价变化为0价,化合价降低,氮元素化合价-3价变化为0价,元素化合价升高,最小公倍数为6,则电子守恒和原子守恒配平书写得到化学方程式为4CuO+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+CuCl2+N2↑+4 H2O,
故答案为:4;2;3;1;1;4H2O;
(2)通过测量生成水的质量来测定M的相对原子质量.a中试剂是浓氨水,
①仪器a名称为分液漏斗用来盛放和滴加液体,a中试剂是浓氨水,仪器b中加入的是氢氧化钠固体或碱石灰,滴入浓氨水固体溶解放热使一水合氨分解生成氨气,
故答案为:分液漏斗;氢氧化钠固体或碱石灰;
②从发生装置中出来的氨气带有水蒸气,必须干燥,故B接D,D接A,吸收反应生成的水用装置D,最后空气中的水不能进入装置D,所以需要装置C,按气流方向正确的装置连接顺序为BDADC,
故答案为:BDADC;
③实验结束时应首先停止从a中滴加液体,熄灭A装置的酒精灯,
故答案为:Ⅱ;
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,
由MxOy~YH2O关系计算
xM+16y 18y
mg ng
M=$\frac{(18m-16n)y}{nx}$,
则M的相对原子质量为$\frac{(18m-16n)y}{nx}$,
故答案为:$\frac{(18m-16n)y}{nx}$;
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶于没有发生变化,说明溶液中没有三价铁离子,反应后的固体成分可能为铁或是铁和氧化铁混合物,因为Fe+2Fe3+=3Fe2+,
故答案为:
| 序号 | 固体成分(填化学式) |
| 1 | Fe |
| 2 | Fe和Fe2O3 |
| 3 |
点评 本题考查了物质组成和产物的实验测定和分析判断,主要是实验过程、实验现象、实验装置连接和顺序的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
 如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.
如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1molN2有6mol电子转移 | D. | 该反应属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| R | W |
| A. | X,Y、R,W四种元素的原于半径依次增大 | |
| B. | Z、W元素与X均可以形成AB2型化合物 | |
| C. | Y元素的最高价氧化物的水化物和其氢化物反应的生成物中仅含有共价键 | |
| D. | Z的氢化物的稳定性大于W的氢化物,是因为Z的氢化物分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
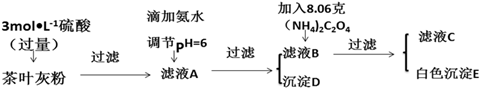
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1氨水中加几滴酚酞,再加等体积的醋酸铵溶液,观察红色是否变浅 | |
| B. | 测定0.1 mol•L-1NH4C1溶液的酸碱性 | |
| C. | 测定0.lmol•L-1氨水的pH | |
| D. | 比较浓度均为0.1 mol•L -1的氨水与NaOH溶液的导电能力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com