
| A. | amol-1 | B. | 2amol-1 | C. | 4amol-1 | D. | 8a mol-1 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用活性炭去除冰箱中的异味 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
查看答案和解析>>
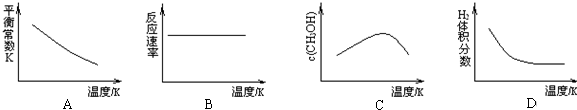
科目:高中化学 来源: 题型:选择题
| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
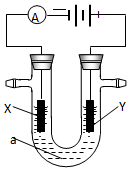 ( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com