
以下微粒含配位键的是 ( )
①N2H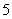 ②CH4 ③OH- ④NH
②CH4 ③OH- ④NH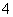 ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.全部
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
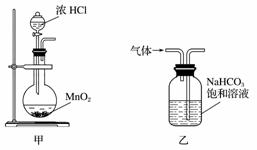
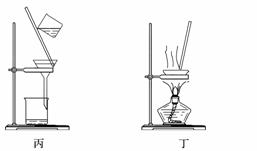
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是__________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力不涉及____________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键
e.氢键 f.范德华力
(4)已知苯酚(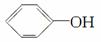 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子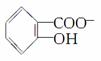 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_________________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于键长、键能和键角的说法中不正确的是( )
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长就越长,共价化合物也就越稳定
D.键角的大小与键长、键能的大小无关
查看答案和解析>>
科目:高中化学 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:________________________________________________________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH--14e-===2CO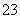 +12H2O。有关此电池的推断不正确的是( )
+12H2O。有关此电池的推断不正确的是( )
A.通入氧气的电极为正极
B.参加反应的O2与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度将下降
D.放电一段时间后,正极区附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)原子的最外层有2个电子的元素一定是ⅡA族元素( )
(2)元素所在的主族序数与最外层电子数之比为1的元素都是金属元素( )
(3)原子及离子的核外电子层数等于该元素所在的周期数( )
(4)原子最外层电子数大于3(小于8)的元素一定是非金属元素( )
(5)某元素的离子的最外层与次外层电子数相同,该元素一定位于第3周期( )
(6)最外层电子数等于或大于3(小于8)的一定是主族元素( )
(7)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族元素或0族元素氦( )
(8)最外层电子数比次外层电子数多的元素一定位于第2周期( )
(9)某元素阴离子最外层电子数与次外层相同,该元素位于第3周期;若为阳离子,则位于第4周期( )
(10)电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期——“阴上阳下”规律( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com