
有关碰撞理论,下列说法中不正确的是( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大
考点:化学反应速率的影响因素.
专题:化学反应速率专题.
分析:活化分子发生反应生成新物质的碰撞为有效碰撞,增大浓度、压强,可增大单位体积活化分子数目,升高温度、加入催化剂,可增大活化分子数目,进而增大反应速率,以此解答该题.
解答: 解:A.活化分子发生反应生成新物质的碰撞为有效碰撞,相互碰撞不一定能发生化学反应,取决于碰撞的方向,故A错误;
B.增大反应物浓度,单位体积内活化分子数增多,可增大反应速率,故B正确;
C.升高温度,使活化分子百分数增加,反应速率增大,故C正确;
D.催化剂能降低反应的活化能,提高活化分子百分数,则增大反应速率,故D正确.
故选A.
点评:本题考查温度、浓度、催化剂对反应速率的影响,题目难度不大,注意对活化分子的浓度以及百分数的影响.


科目:高中化学 来源: 题型:
下列化学反应对应的离子方程式书写正确的是( )
A. 漂白粉溶液在空气中生效:Ca2++2ClO﹣+CO2+H2O=2HClO+CaCO3↓
B. 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣
C. 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+
D. 0.01 mol•L﹣1NH4Al(SO4)2溶液与0.02 mol•L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3•H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
关于食物的酸碱性说法错误的是( )
A.蛋白质在体内经消化后生成碳酸.硫酸.尿酸等,故它属于酸性食物
B.葡萄吃起来是酸的,故它属于酸性食物
C.食物的酸碱性与化学上所指溶液的酸碱性不同的
D.正常人人体内各体液pH总保持一定范围
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A(g)+3B(g)⇌2C(g)+2D(g),下列反应速率最大的是( )
A.v(D)=0.4 mol•L﹣1•s﹣1 B.v (C)=0.5 mol•L﹣1•s﹣1
C.v (B)=0.6 mol•L﹣1•s﹣1 D.v (A)=0.15 mol•L﹣1•s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)⇌Z(g)+W(s);△H>0下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.平衡后加入X,上述反应的△H增大
C.升高温度,平衡逆向移动
D.当容器中气体压强不变时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
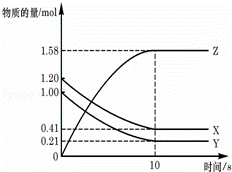
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L•s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y转化了0.79mol
D.反应的化学方程式为:X(g)+Y(g)⇌Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是一个巨大的化学资源宝库.
(1)海底蕴含着储量巨大的甲烷水合物,CH4被认为是21世纪新型洁净的能源.在25℃、101kPa时,16g CH4气体完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式是 .
(2)下列关于甲烷燃烧的说法正确的是 (填序号).
A.天然气属于化石燃料,属于不可再生的能源
B.该反应中,反应物所具有的总能量高于生成物所具有的总能量
C.25℃、101kPa 时,16g的CH4完全燃烧生成气态水时放出的热量大于890.31kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe(OH)3胶体虽然是由FeCl3溶液制得,但两者是截然不同的两种物质.FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
A. 都呈透明的红褐色
B. 分散质颗粒直径相同
C. 都比较稳定,密封保存一段时间都不会产生沉淀
D. 当有光线透过时,都能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学进行试验探究时,欲配制1.0mol•L﹣1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. |
|
| 步骤2:取适量滤液于试管中,滴加稀硫酸. |
|
| 步骤3:取适量步骤1中的沉淀于是试管中, |
|
| 步骤4: |
|
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:
①配制250ml 约0.1mol•L﹣1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将
(填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L﹣1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下, (填“能”或“不能”) 配制1.0mol•L﹣1Ba(OH)2溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com