
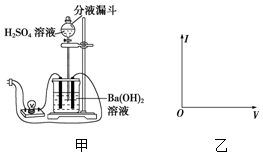
 使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:
使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:分析 向H2SO4溶液中滴加Ba(OH)2溶液至反应完全,发生的离子反应方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,随着硫酸的滴入,溶液中离子的浓度逐渐减小、溶质逐渐减少,导电能力减弱,当两种溶液恰好完全反应时,溶液中几乎没有自由移动的离子,所以电流计偏转程度逐渐减小,最后为零,再加入硫酸,得到的是硫酸溶液,导电能力会逐渐增强,说明溶液的导电性与溶液的离子浓度有关,以此解答该题.
解答 解:(1)实验前为氢氧化钡溶液,溶液中存在大量Ba2+、OH-,具有溶液导电,可观察到灯泡明亮,故答案为:灯泡明亮;溶液中存在大量Ba2+、OH-;
(2)反应开始一段时间,氢氧化钡和硫酸发生中和反应,生成水和硫酸钡沉淀,发生Ba(OH)2+H2SO4═BaSO4↓+2H2O,溶液中离子浓度降低,导电能力下降,灯泡变暗,
故答案为:灯泡变暗;Ba(OH)2+H2SO4═BaSO4↓+2H2O,溶液中的离子浓度逐渐减小;
(3)当两种物质完全反应时,溶液中离子浓度很小,几乎为0,则导电能力最低,灯泡变暗,故答案为:灯泡熄灭;溶液中离子浓度很小,几乎为0;
(4)继续滴加硫酸,溶液中离子浓度增大,则灯泡逐渐变亮,故答案为:灯泡逐渐变亮;溶液中离子浓度又逐渐增大;
(5)滴加硫酸之前,氢氧化钡浓度最大,导电性最强,但随着反应的进行,溶液浓度逐渐降低,导电性减弱,硫酸过量时,导电能力又逐渐增强,如图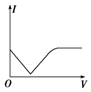 ,
,
故答案为: .
.
点评 本题考查元素化合物性质及离子反应、溶液导电性等知识点,为高频考点,明确导电性与离子浓度关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 7.8g | B. | 15.6g | C. | 3.9g | D. | 78g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应中其还原剂是Na2O2.
,反应中其还原剂是Na2O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③⑤ | C. | ③④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | IBr+H2O═HIO+HBr | ||
| C. | 2Na2O2+4HCl═4NaCl+O2+2H2O | D. | NaH+H2O═NaOH+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融氯化钠可制金属钠 | |
| B. | 钠与氧气反应的产物与反应条件无关 | |
| C. | ClO2可用于自来水的消毒 | |
| D. | “氯碱工业”是指电解食盐水制取氯气等产品的工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2•12H2O能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | SO2有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | MnO2有较强的氧化性,可作H2O2分解的氧化剂 | |
| D. | Si是半导体材料,可用于制光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com