
【题目】新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.抗氧化 B. 氧化细菌 C.增酸作用 D. 漂白
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图的实验:

(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由___________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学方程式______,C中每消耗2molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为____________,现象是_______。
【答案】AC 不合理;实验对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO2含量很低,所以也不能使品红褪色 Na2SO3 +H2SO4 = Na2SO4 + SO2↑+ H2O 4NA 酸性KMnO4 2MnO4— + 5SO2 +2 H2O = 2Mn2+ + 5SO42— + 4H+(或FeCl3溶液,SO2 +2 Fe3+ +2 H2O = 2 Fe 2+ + SO42— + 4H+) 红色溶液变浅或褪色(或溶液由棕黄色变为浅绿色)
【解析】
(1)二氧化硫具有较强的还原性,可以防止葡萄酒被氧化,二氧化硫的水溶液显酸性,可以增强葡萄酒的酸性,二氧化硫有漂白性,但二氧化硫的含量很少,没有将葡萄酒漂白,故选AC;
I.(2)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果,干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少,故答案为:不合理,实验对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO2含量很低,所以也不能使品红褪色;
Ⅱ.实验方案二:装置A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,A装置中亚硫酸钠与浓硫酸反应放出二氧化硫,二氧化硫被干燥后与过氧化钠反应生成硫酸钠,反应的方程式为SO2+Na2O2=Na2SO4,根据方程式,每消耗2molNa2O2,转移4mol电子,故答案为:SO2+Na2O2=Na2SO4;4NA;
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂选择酸性KMnO4,高锰酸钾具有强氧化性,被二氧化硫还原褪色,发生反应的离子方程式为2MnO4— + 5SO2 +2 H2O = 2Mn2+ + 5SO42— + 4H+(或FeCl3溶液,SO2 +2 Fe3+ +2 H2O = 2 Fe 2+ + SO42— + 4H+);故答案为:酸性KMnO4;2MnO4— + 5SO2 +2 H2O = 2Mn2+ + 5SO42— + 4H+(或FeCl3溶液,SO2 +2 Fe3+ +2 H2O = 2 Fe 2+ + SO42— + 4H+);红色溶液变浅或褪色(或溶液由棕黄色变为浅绿色)。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.在平衡(I)和平衡(II)中M的体积分数相等
D.达平衡(I)时,X的转化率为5/11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国对可呼吸的钠——二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2![]() 2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是

A. 放电时,当转移1 mol电子时负极质量减轻23 g
B. 充电时,Na+从阳极向阴极移动
C. 放电时,正极反应式为3CO2+4Na++4e-=2Na2CO3+C
D. 可以用乙醇代替TEGDME作有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常见的荧光棒的发光原理可用下式表示,上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光。下列说法正确的是

A. 上述反应是酯的水解反应
B. 荧光棒发光过程涉及化学能到光能的转化
C. 二苯基草酸酯核磁共振氢谱有4个吸收峰
D. 二苯基草酸酯与草酸![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用高浓度含砷废水(主要成分为H3AsO3)制取As2O3的工艺流程如下图所示。
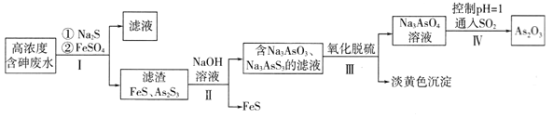
已知:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)
2AsS33-(aq)
(1)H3AsO3中As元素的化合价为______;H3AsO3的第一步电离方程式为:________。
(2)步骤I加入FeSO4的作用是______________________。
(3)步骤Ⅱ发生反应的化学方程式为___________________。步骤III“氧化脱硫”过程中被氧化的元素是___________(填元素符号)。
(4)步骤IV发生反应的离子方程式为________________________。
(5)利用反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
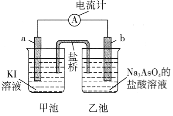
①起始时,b电极的电极反应式为__________________。
②一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是______________________________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可用于生产聚酯纤维,可通过下列路线合成(某些反应的反应物和反应条件未列出):

(1)写出反应①、⑦的化学方程式:
①____________________________________________________________________________;
⑦____________________________________________________________________________。
(2)上述七个反应中属于消去反应的有____________(填反应序号)。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃时,pH=1的盐酸溶液中,由水电离出的H+个数为10-13NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
C. 1L0.1molL-1NaHCO3溶液中含有0.1NA个HCO3-
D. 100gCaCO3与KHCO3的混合物中含有的阴离子的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com