
| A. | 云母是热的不良导体.传热不均匀 | |
| B. | 石蜡是热的不良导体.传热不均匀 | |
| C. | 石蜡具有各向异性,不同的方向导热性不同 | |
| D. | 云母具有各向异性,不同的方向导热性不同 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
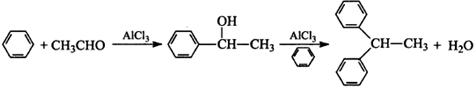
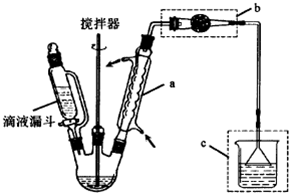
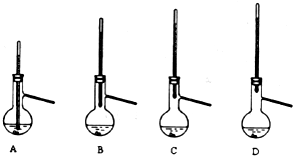
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核电荷数为92 | B. | 质子数为143 | C. | 中子数为235 | D. | 核外电子数为235 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
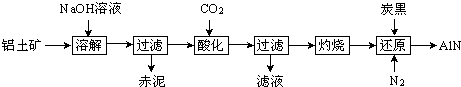
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
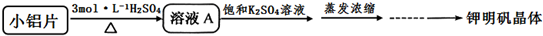
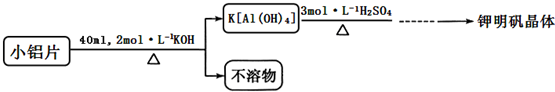
| 温度(℃) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| K2SO4 | 7.4 | 9.2 | 11.1 | 12.97 | 14.8 | 16.6 | 18.17 | 19.8 | 21.4 | 22.4 | 24.1 |
| Al2(SO4)3•18H2O | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 | 59.2 | 66.2 | 73.1 | 86.8 | 89.0 |
| KAl(SO4)2•12H2O | 3.0 | 4.0 | 5.9 | 8.4 | 11.7 | 17.0 | 24.8 | 40.0 | 71.0 | 109.0 | 154.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+2Q | B. | M+4Q | C. | 2Q | D. | 2M+2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:Z<X | |
| C. | Y、Z的氧化物都有两性 | |
| D. | Y、W最高价氧化物对应水化物间可以相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com