
【题目】25℃时,在50 mL 0.1 mol·L1的NaOH溶液中逐滴加入0.2 mol·L1的醋酸,溶液pH随所加醋酸的体积变化曲线如图。下列说法正确的是

A.在A、B之间任意一点都满足:c(Na+)>c(CH3COO)>c(OH)>c(H+)
B.在B点,a>25,且c(Na+)=c(CH3COO)=c(OH)=c(H+)
C.在C点:c(Na+)>c(CH3COO)>c(H+)>c(OH)
D.在D点:c(OH) +c(Na+)=c(CH3COOH)+c(H+)
【答案】D
【解析】选项A,由图像可知在A、B之间,靠近A点附近对应的溶液中NaOH过量,溶液中c(OH)>c(CH3COO),由此可判断A项错误。选项B,在B点,因溶液呈中性则醋酸略过量,a>25,但此时c(CH3COO)= c(Na+)>c(H+)=c(OH),错误。选项C,在C点醋酸过量,则:c(CH3COO)>c(Na+)>c(H+)>c(OH),错误。选项D,用物料守恒:c(CH3COO)+c(CH3COOH)=2c(Na+)减去电荷守恒:c(OH)+ c(CH3COO)= c(Na+)+c(H+)即可得:c(OH) + c(Na+)=c(CH3COOH)+ c(H+),正确。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
【题目】恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:3A(g)![]() 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是( )
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是( )
A. 若x=2,则p>0.5a B. 若x=3,则p>0.7a
C. 若x=4,则p= a D. 若x= 5,则p≥a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习了铜与浓硫酸的反应后,某班同学用如下实验探究Mg与浓硫酸反应的气体产物。回答下列问题:
(1)足量Mg与浓硫酸反应

①Mg与浓硫酸反应的气体制备装置可选择上图中的_______,由Cu与浓硫酸的反应可知Mg与浓硫酸反应的主要化学方程式为____________________________。
②设计实验验证Mg与浓硫酸反应的主要气体产物的方法:____________________________。
(2)Mg与浓硫酸反应杂质气体的探究

①随着Mg与浓硫酸的反应进行,逐渐产生一种还原性气体,该气体是__________(写化学式)。
②为探究这种气体的存在,可采用上述组合后的装置,装置连接顺序是__________________→F,其中装置F的玻璃管中盛有的固体药品名称是_____________________,该装置中干燥管内的碱石灰的作用是_____________________。
③装置B的现象是_____________________。
④装置C的作用是__________________________。
⑤装置E中发生反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法仅标出电子转移情况___________________________________________________________。
(2))实验室制取Cl2的反应方程式之一为:
___ KMnO4 + ____ HCl —— ____KCl +____MnCl2 + ___ C12↑ + ___ H2O
请①配平方程式;②用单线桥法仅标出电子转移情况_________;
③浓盐酸表现出来的性质是:_______________;
④当有5摩HCl被氧化时,求产生的氯气在标准状况下的体积:___________。
(3)KClO3+6HCl===KCl+3Cl2↑+3H2O写出氧化产物还原产物物质的量的比为_________,当氧化产物比还原产物多71克时,参加反应的还原剂为________摩。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银是一种美丽的银白色的金属,其导电性和导热性非常好,银及其合金广泛应用于电子电器材料、感光材料、化工材料等方面。
(1)银与铜同族,铜元素在周期表中的位置是__________。基态铜原子的电子排布式是____________________。
(2)Ag+能与NH3、![]() 、CN等形成配位数为2的配合物。
、CN等形成配位数为2的配合物。
①C、N、O三种元素的第一电离能从大到小的顺序为__________。
②利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有__________(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③![]() 中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与
中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与![]() 、SO2互为等电子体的短周期元素单质分子的化学式__________。
、SO2互为等电子体的短周期元素单质分子的化学式__________。
(3)银晶体的晶胞如图所示,为面心立方最密堆积,则银原子的配位数为__________。
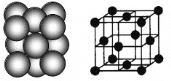
晶体空间利用率是指构成晶体的微粒在整个晶体空间中所占的体积分数,即空间利用率=![]() ×100%。则银晶体的空间利用率为__________(保留2位有效数字,
×100%。则银晶体的空间利用率为__________(保留2位有效数字,![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铜等金属离子是人体内多种酶的辅因子。
(1)Cu位于元素周期表第四周期,铜原子核外电子有____种不同的运动状态,Cu+的核外电子排布式为________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴、阳离子个数比为______。

(3)Mg是第三周期元素,该周期部分元素氟化物的熔点下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2===4AlCl3+3O2。
回答以下问题:
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2△,AlCl3+X↑,则气体X可能是
___________________________________________________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式:______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg ![]() MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com