
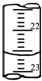
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |


科目:高中化学 来源: 题型:
| A、标准状况下,2.24LCHCl3的分子数0.1NA |
| B、1molNH3中含有3NA对电子 |
| C、9.2g NO2和N2O4的混合气中含有的氮原子数为大于0.2NA |
| D、某氯化铁溶液中Fe3+的数目为NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
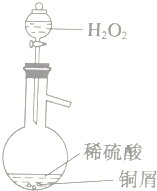
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.某中和滴定实验过程如下:
I.某中和滴定实验过程如下:| 滴定序号 | 待测液体积(mL) | 所消耗盐酸体积(mL)(滴定前) | 所消耗盐酸体积(mL)(滴定后) | 所消耗盐酸体积(mL) |
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
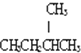 ;D:
;D: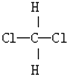 和
和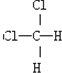

查看答案和解析>>
科目:高中化学 来源: 题型:
 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.滴定次数 实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.80 | 15.00 | 15.02 | 14.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:
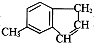 )是一种医药合成中间体,某同学设计它的合成路线如下:
)是一种医药合成中间体,某同学设计它的合成路线如下: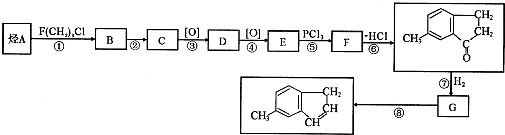
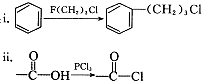
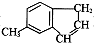 )的说法正确的是
)的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠的还原性很强,在空气中易变质,久置后变为过氧化钠 |
| B、氢氧化钠溶液可长时间保存在带磨口玻璃塞的试剂瓶中 |
| C、新制的氯水通常保存在棕色玻璃试剂瓶中,并现用现配 |
| D、漂粉精的有效成分为氯化钙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com