
下图中A—F均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D 为金属单质。(反应过程中水及其他产物已略去) 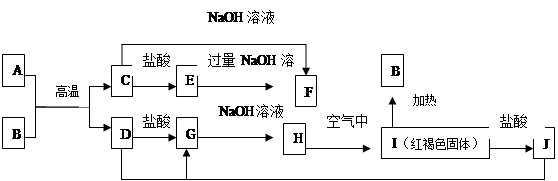
(1)C是 ,J是 (填化学式)。
(2)写出C与NaOH反应生成F的化学方程式
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学反应方程式 :
(1) Al2O3,(2分) FeCl3(2分)
(2)Al2O3+2NaOH=2NaAlO2 + H2O (2分)
(3)2Al+2NaOH+2H2O=2NaAlO2 +3H2 ↑(2分)
解析试题分析:(1)由I红褐色固体知I为氢氧化铁,D为单质,所以根据元素守恒得D为铁单质;C能与氢氧化钠溶液反应,猜想C为氧化铝,则A与B的反应是铝与氧化铁高温炼铁的反应。所以C为Al2O3,J为FeCl3
(2)C为氧化铝,与氢氧化钠溶液反应生成偏铝酸钠和水,化学方程式为Al2O3+2NaOH=2NaAlO2 + H2O
(3)A为单质Al,与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2 +3H2↑
考点:考查元素推断,铝及氧化铝与氢氧化钠溶液的反应


科目:高中化学 来源: 题型:填空题
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应: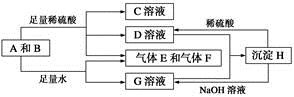
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为_____________________________。
(3)D与G两溶液混合后发生反应的离子方程式为____________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为 mol。
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H= 。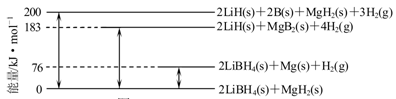
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是 (填字母)。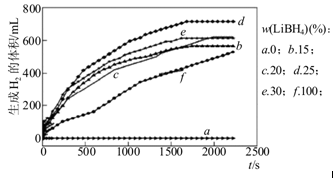
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。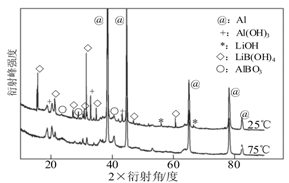
从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式),产生Al(OH)3的化学方程式为 。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH (填“增大”、“减小”或“不变”),负极的电极反应式为 。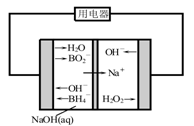
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:______________________________________ (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______________________,该电池总反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
苏打和小苏打有着广泛的应用。试从反应物用量角度说明在下列用途中选A(苏打)还是B(小苏打),并说明原因。
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用______,因为______________________________
(2)作为泡沫灭火器的药品,选用________,因为________________________
(3)用于洗涤餐具及实验室的玻璃仪器等,选用________,因为_____________
(4)治疗胃酸过多时,选用________,因为_______________________________
(提示:二者水溶液均显碱性,且苏打的碱性强)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、X均为中学常见的纯净物,它们之间有如图转化关系(副产物已略去)。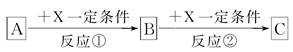
回答下列问题:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若A、B、C为含金属元素的无机化合物,X为强电解质溶液,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为________________________或________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为_______mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是______________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液I的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:___________mol(用含有m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式) 。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号) 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈现蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是 。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com