
 Cu(OH)2+2H+,增大氢离子浓度,抑制Cu2+水解(结合离子方程式并简要说明).
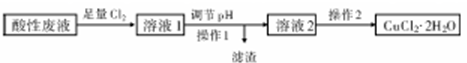
Cu(OH)2+2H+,增大氢离子浓度,抑制Cu2+水解(结合离子方程式并简要说明).分析 酸性废液中(含FeCl3、FeCl2含CuCl2)制备氯化铜晶体(CuCl2•2H2O),由流程可知,先通入足量氯气可氧化FeCl2,然后加CuO促进铁离子水解转化为沉淀,过滤后得到滤渣为氢氧化铁,溶液2中含CuCl2,在氯化氢气流中蒸发结晶得到CuCl2•2H2O,
(1)Fe3+与KSCN溶液结合生成血红色的络离子,酸性废液中加入足量Cl2,与氯化亚铁反应生成氯化铁;
(2)操作I分离溶液与固体,调节pH不能引入新杂质,结合Ksp计算;
(3)操作2中抑制铜离子水解,且水解生成的HCl易挥发;
(4)发生氧化还原反应生成CuCl;
(5)由2Cu2++4I-=2CuI↓+I2可知,石墨为阴极,以Cu为阳极电解KI溶液,通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,电极反应式为2H2O+2e-=H2↑+2OH-.
解答 解:酸性废液中(含FeCl3、FeCl2含CuCl2)制备氯化铜晶体(CuCl2•2H2O),由流程可知,先通入足量氯气可氧化FeCl2,然后加CuO促进铁离子水解转化为沉淀,过滤后得到滤渣为氢氧化铁,溶液2中含CuCl2,在氯化氢气流中蒸发结晶得到CuCl2•2H2O,
(1)检验酸性废液中含有Fe3+,常用的试剂是KSCN;酸性废液中加入足量Cl2,反应的化学方程式为 2FeCl2+Cl2=2FeCl3,
故答案为:KSCN; 2FeCl2+Cl2=2FeCl3;
(2)操作I分离溶液与固体,为过滤操作,调节pH不能引入新杂质,只有CuO符合,若调节溶液的pH为4时,溶液中残留的Fe3+物质的量浓度为$\frac{4×1{0}^{-38}}{(1{0}^{-10})^{3}}$=4×10-8mol•L-1,
故答案为:过滤; D; 4×10-8mol•L-1;
(3)操作2需在氯化氢气流中经过加热浓缩、冷却结晶、过滤、洗涤、干燥.在氯化氢气流中进行操作的原因是Cu2++2H2O  Cu(OH)2+2H+,增大氢离子浓度,抑制 Cu2+水解,
Cu(OH)2+2H+,增大氢离子浓度,抑制 Cu2+水解,
故答案为:冷却结晶;Cu2++2H2O  Cu(OH)2+2H+,增大氢离子浓度,抑制 Cu2+水解;
Cu(OH)2+2H+,增大氢离子浓度,抑制 Cu2+水解;
(4)若在溶液2含氯化铜,通入一定量的SO2,加热,则生成CuCl沉淀,该反应的离子方程式为2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+,
故答案为:2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(5)Cu与电源正极相连,Cu作阳极,则Cu失去电子生成铜离子,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,阴极反应式为2H2O+2e-=H2↑+2OH-,故答案为:正;2H2O+2e-=H2↑+2OH-.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程、发生的反应、盐类水解及溶度积计算等为解答的关键,侧重分析与应用能力的考查,注意反应原理与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 11% | B. | 19% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于有热量放出的反应的是②③ | B. | 属于化合反应的是①② | ||
| C. | 属于有化合价变化的反应是④⑤ | D. | 属于复分解反应的是③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
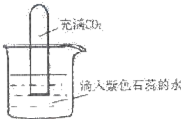 如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )| A. | ①② | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定某溶液的pH | |
| B. | 用25 mL碱式滴定管量取14.80 mL 1 mol/L NaOH溶液 | |
| C. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| D. | 用托盘天平称取25.20 gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| C. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com