
【题目】写出符合下列要求的离子方程式:
(1)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合_________________;
(2)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钙溶液混合____________________;
(3)等体积、等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合____________________;
(4)氢氧化钙与碳酸氢钠等物质的量在溶液中反应______________________________;
(5)氢氧化钙与碳酸氢钠按物质的量比1∶2在溶液中反应______________________________。
【答案】Ca2++![]() +OH-=CaCO3↓+H2O Ca2++
+OH-=CaCO3↓+H2O Ca2++![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O ![]() + Ba2++OH-=BaCO3↓+H2O Ca2++
+ Ba2++OH-=BaCO3↓+H2O Ca2++![]() +OH-=CaCO3↓+H2O Ca2++2
+OH-=CaCO3↓+H2O Ca2++2![]() +2OH-=CaCO3↓+2H2O+
+2OH-=CaCO3↓+2H2O+![]()
【解析】
(1)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合生成碳酸钙沉淀、碳酸氢钠和水,离子方程式为:Ca2++![]() +OH-=CaCO3↓+H2O;
+OH-=CaCO3↓+H2O;
(2)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钙溶液混合生成碳酸钙沉淀和水,离子方程式为:Ca2++![]() +OH-=CaCO3↓+H2O;
+OH-=CaCO3↓+H2O;
(3)等体积、等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合生成碳酸钡沉淀、氢氧化钠和水,离子方程式为:![]() + Ba2++OH-=BaCO3↓+H2O;
+ Ba2++OH-=BaCO3↓+H2O;
(4)氢氧化钙与碳酸氢钠等物质的量在溶液中反应生成碳酸钙沉淀、氢氧化钠和水,离子方程式为:Ca2++![]() +OH-=CaCO3↓+H2O;
+OH-=CaCO3↓+H2O;
(5)氢氧化钙与碳酸氢钠按物质的量比1∶2在溶液中反应,生成碳酸钙沉淀、碳酸钠和水,离子方程式为:Ca2++2![]() +2OH-=CaCO3↓+2H2O+
+2OH-=CaCO3↓+2H2O+![]() 。
。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】燃烧热是指在25℃,101kPa,1mol可燃物完全燃烧生成稳定的化合物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)=CO2(g) ΔH= -283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8kJ·mol-1
则下列说法正确的是
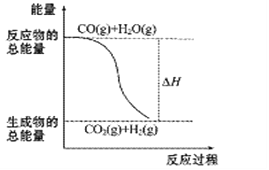
A. H2的燃烧热为241.8 kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l) ΔH> -241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol钠和1mol铝的混合物小心地投入932g水中,充分反应,计算:
(1)生成气体的质量为多少______?
(2)溶液中有几种溶质______?
(3)各溶质的质量分数为多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中不正确的是( )
A.小苏打是面包发酵粉的主要成分之一
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.用酚酞溶液可鉴别饱和食盐水和饱和纯碱溶液
D.NaHCO3的热稳定性大于Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,9.5g羟基(—18OH)中所含中子数为5NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.2molFeBr2与足量氯气反应时,转移的电子数为6NA
D.甲烷燃料电池的正极消耗22.4LO2(标准状况下),电路中通过的电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置制取氯气,并收集氯气进行实验。
请完成下列问题:
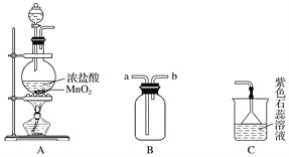
(1)装置A中发生反应的离子方程式为______________________________________。
(2)装置B如图中所示正放,则连接A的接口是________(填序号)。
(3)实验中可观察到装置C中紫色石蕊溶液的现象是__________________,其原因______________________________________________________________________。
(4)取出B中的集气瓶进行氯气与铜的反应实验,应该进行的操作是______________,然后立刻放入充满氯气的集气瓶中。实验中有同学提出应该在集气瓶底先放少量的水或细沙,你认为__________(填“需要”或“不需要”)放,理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 304 | 670 |
沸点/℃ | 132 | 173 | 316,易升华 | 700 |
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原少量无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为B→A→___→___→___→E(填字母,装置可多次使用);A中长颈漏斗的作用_____________。
③C中盛放的试剂是_____________。
(2)利用反应2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
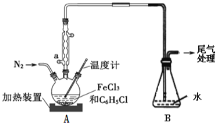
①仪器a的作用是__________。
②反应中提供过量氯苯的作用是__________。
③反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250 mL,量取25.00 mL所配溶液,用0.400 mol/L的NaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为: 。
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)![]() CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)![]() CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)的ΔH= ;
CH3OCH3(g) + CO2(g)的ΔH= ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com