
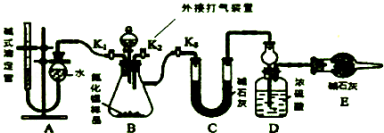
分析 从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数,以此分析解答;
(1)①Al4C3与硫酸反应可生成CH4和硫酸铝;
②根据题目信息:AlN溶于强碱溶液时会生成NH3来书写方程式;
(3)②关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量;
③关闭活塞K1,打开活塞K3,用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量;
(4)①通入空气一段时间,排尽装置的氨气,被装置D完全吸收;
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小;
③根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,可求得Al4C3的质量分数,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数.
解答 解:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;
(1)①碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷,碳化铝与硫酸反应可理解为碳化铝(Al4C3)与水反应,产物再和硫酸反应,所以产物为硫酸铝和甲烷,反应方程式为:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑,离子方程式为:Al4C3+12H+=4Al3++3CH4↑,
故答案为:Al4C3+12H+=4Al3++3CH4↑;
②根据题目信息:AlN溶于强碱溶液时会生成NH3,化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)②关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,
故答案为:H2SO4;
③关闭活塞K1,打开活塞K3,用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,
故答案为:NaOH;
(4)①装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小,
故答案为:打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收;
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,
故答案为:偏小;
③甲烷的体积为(a-b)mL,物质的量为$\frac{(a-b)×10{\;}^{-3}}{V{\;}_{m}}$mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为$\frac{1}{3}$×$\frac{(a-b)×10{\;}^{-3}}{V{\;}_{m}}$mol×144g/mol=$\frac{48(a-b)×10{\;}^{-3}}{V{\;}_{m}}$g,Al4C3的质量分数为$\frac{0.048(a-b)}{V{\;}_{m}•X}$×100%,
氨气的质量为(z-y)g,物质的量为$\frac{Z-Y}{17}$mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为$\frac{Z-Y}{17}$mol×41g/mol=$\frac{41(Z-Y)}{17}$g,故AlN的质量分数为$\frac{\frac{41(Z-Y)}{17}}{X}$×100%=$\frac{41(Z-Y)}{17X}$×100%,
故答案为:$\frac{0.048(a-b)}{V{\;}_{m}•X}$×100%;$\frac{41(Z-Y)}{17X}$×100%.
点评 本题是一道关于物质的组成和含量测定知识的综合考查题,侧重考查学生知识综合应用能力,要求学生具有分析和解决问题的能力,综合性较强,注意把握相关实验原理,题目难度大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 中性溶液中pD=8-lg4 | |
| B. | 含有0.01 mol NaOD的D2O溶液1 L,pD=12.0 | |
| C. | 溶解0.01 mol DCl的D2O溶液1 L,pD=12.0 | |
| D. | 在100 mL 0.25 mol/L的DCl重水溶液中,加入50 mL 0.20 mol/L NaOD重水溶液,pD=1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴入氢氧化钠溶液:CO32-+H++OH-=CO32-+H2O | |
| B. | 浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+H2O | |
| C. | 用NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 向氢氧化钠溶液中通入过量的二氧化碳:CO2+2OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子由原子核和核外电子构成 | |
| B. | 对于任何微粒,质子数等于核外电子数都成立 | |
| C. | 当微粒达到稳定结构时,最外层电子数一定是8 | |
| D. | 原子的质量等于原子核的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com