
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )
A.Na+(g)+Cl-(g)===NaCl(s) ΔH
B.Na(s)+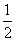 Cl2(g)===NaCl(s) ΔH1
Cl2(g)===NaCl(s) ΔH1
C.Na(s)===Na(g) ΔH2
D.Na(g)-e-===Na+(g) ΔH3
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
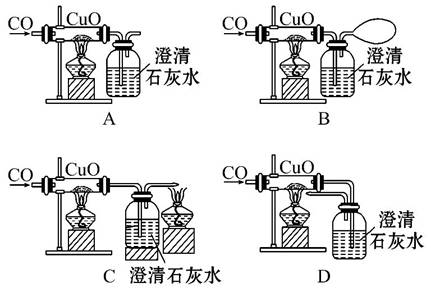
某课外活动小组在学习CO的化学性质时,准备做CO还原CuO的实验。下面是同学们设计的四套实验装置图。从安全和能源充分利用的角度来看,你认为最理想的实验装置是( )
查看答案和解析>>
科目:高中化学 来源: 题型:
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC________Si;SiCl4________SiO2。
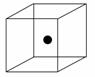
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)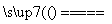 Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,
B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子。
(1)C原子的电子排布式为________________________________________________,
若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合
物中的共价键属于________键。
(2)当n=2时,B的原子结构示意图为__________,B与C形成的化合物晶体属于____________晶体。当n=3时,B与C形成的化合物的晶体中微粒间的作用力是_____。
(3)

若D元素与Fe形成某种晶体,该晶体的晶胞结构如右图所示,则晶体的化学式是___(用元素符号表示);若晶胞的边长为a nm,则合金的密度为______________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子间距离/10-10m | 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原
子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融
时能导电。试回答下列问题:
(1)A、B的元素符号分别是________、________。
(2)用电子式表示A、B元素形成化合物的过程:_____________________________
________________________________________________________________________。
(3)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了
________个阴离子;晶体中阴、阳离子数之比为__________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是
________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定微粒的个数比为2∶1的是( )
A.Be2+离子中的质子和电子
B.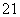 H原子中的中子和质子
H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
据某科学杂志报道,国外有一研究机构发现了一种新的球形分子,它的分子式为C60Si60,其分子结构酷似中国传统工艺“镂雕”,经测定其中包含C60,并且也有Si60结构,下列叙述不正确的是( )
A.该物质有很高的熔点,很大的硬度
B.该物质形成的晶体属于分子晶体
C.该物质分子中C60被包裹在Si60里面
D.该物质的相对分子质量为2 400
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com