
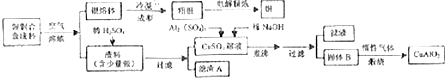
分析 (1)电解精炼银时,所选的电解质是含有银离子的盐溶液;滤渣A为银,和稀硝酸反应生成硝酸银、一氧化氮和水,根据反应物、生成物来书写方程式;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,根据Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃判断产物;沉淀的洗涤方法:沿玻璃棒向过滤器中加蒸馏水,至完全淹没沉淀,静置待液体全部流下,再重复此操作2~3次至洗涤干净;
(3)过量的硫酸能和检验醛基的氢氧化铜发生中和反应,所以需在碱性条件下进行,加碱生成偏碱性的氢氧化铜悬浊液,葡萄糖为五羟基醛和新制Cu(OH)2发生氧化还原反应生成葡萄糖酸或其盐和砖红色的氧化亚铜;
(4)根据化合价升降总数相等以及原子守恒来配平;
(5)根据铜元素守恒建立关系式:Cu~CuAlO2来计算.
解答 解:(1)电解精炼银时,所选的电解质是含有银离子的盐溶液,可选用硝酸银溶液;滤渣A为银,和稀硝酸反应:3Ag+4HNO3(稀)═3AgNO3+NO↑+2H2O,
故答案为:AgNO3;3Ag+4HNO3(稀)═3AgNO3+NO↑+2H2O;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO,过滤得到固体B时,进行沉淀的洗涤,方法为:将固体置于漏斗中,沿玻璃棒向过滤器中慢慢加蒸馏水,至完全淹没沉淀,静置待液体全部流下,再重复此操作2~3次至洗涤干净,
故答案为:Al(OH)3和CuO;将固体置于漏斗中,沿玻璃棒向过滤器中慢慢加蒸馏水,至完全淹没沉淀,静置待液体全部流下,再重复此操作2~3次至洗涤干净;
(3)过量的硫酸能和检验醛基的氢氧化铜发生中和反应,所以需在碱性条件下进行,加碱2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,葡萄糖与新制Cu(OH)2悬浊液共热,方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$$\stackrel{水浴}{→}$CH2OH(CHOH)4COONa+Cu2O↓+3H2O或CH2OH(CHOH)4CHO+2Cu(OH)2$\stackrel{水浴}{→}$$\stackrel{△}{→}$CH2OH(CHOH)4COOH+Cu2O↓+2H2O;
故答案为:液中加过量氢氧化钠,生成偏碱性的氢氧化铜悬浊液;CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$$\stackrel{水浴}{→}$CH2OH(CHOH)4COONa+Cu2O↓+3H2O或CH2OH(CHOH)4CHO+2Cu(OH)2$\stackrel{△}{→}$$\stackrel{水浴}{→}$CH2OH(CHOH)4COOH+Cu2O↓+2H2O;
(4)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:4;2;4;O2;
(5)设含铜的质量分数为64%的银铜合金废料的质量为x,由关系式:Cu~CuAlO2得$\frac{x×64%}{64}$=$\frac{6.15}{123}$,解得x=5,故答案为:5.
点评 本题以银铜合金制备钢化工产品为背景,考查了电解原理、沉淀的判断、氧化还原反应的配平以及化学计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含共用电子对数目为$\frac{a}{7+1}$NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$ L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②③ | C. | ①②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 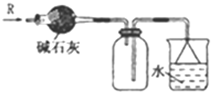 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 | |
| B. | 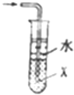 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| C. |  进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 | |
| D. | 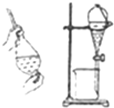 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配体为水分子,配原子为O,外界为Br- | |
| B. | 中心离子的配位数为6 | |
| C. | 中心离子Cr3+采取sp3杂化 | |
| D. | 中心离子的化合价为+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com