
 短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等, ,R的最简单氢化物的电子式为
,R的最简单氢化物的电子式为 ,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).
,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).分析 由短周期元素Q、R、T、W所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素.
(1)T的为Al,原子核外有3个电子层,各层电子数为2、8、3;R的最简单氢化物为氨气;Q的1:1型氢化物中相对分子质量最小的分子为CH≡CH;
(2)硫酸的酸性大于碳酸的酸性,可比较非金属性;
(3)W为S,其最高价氧化物的水化物浓溶液为浓硫酸,二者反应生成二氧化硫和水;
(4)R为N元素,有多种氧化物,其中甲的相对分子质量最小,则甲为NO,根据电子转移守恒计算氧化产物中N元素化合价,进而确定所生成的R的含氧酸盐的化学式.
解答 解:由短周期元素Q、R、T、W所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素.
(1)T的为Al,原子核外有3个电子层,各层电子数为2、8、3,Al的原子结构示意图为 ;R的最简单氢化物为氨气,其电子式为
;R的最简单氢化物为氨气,其电子式为 ;Q的1:1型氢化物中相对分子质量最小的分子为CH≡CH,C为sp杂化,为直线分子;
;Q的1:1型氢化物中相对分子质量最小的分子为CH≡CH,C为sp杂化,为直线分子;
故答案为: ;
; ;直线;
;直线;
(2)硫酸的酸性大于碳酸的酸性,可比较非金属性Q<W,故答案为:弱于;
(3)W为S,其最高价氧化物的水化物浓溶液为浓硫酸,二者反应生成二氧化硫和水,该反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2+2H2O,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2+2H2O;
(4)R为N元素,有多种氧化物,其中甲的相对分子质量最小,则甲为NO,在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,设氧化产物中N元素化合价为a,根据电子转移守恒:2(a-2)=0.5×4,解得a=3,所生成的R的含氧酸盐的化学式是NaNO2,
故答案为:NaNO2.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语及氧化还原反应的使用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | V(SO2)=4mol•L-1•min-1 | B. | V(O2)=3mol•L-1•min-1 | ||
| C. | V(SO3)=0.1mol•L-1•S-1 | D. | V(O2)=0.1mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
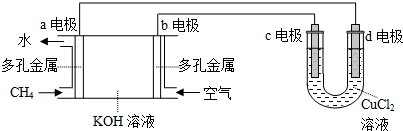
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
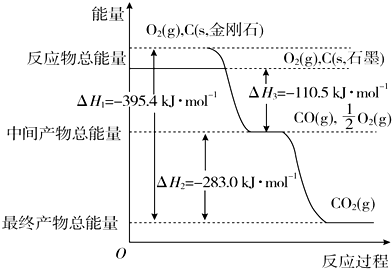
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
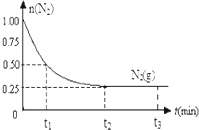 一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.
一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
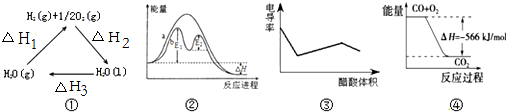
| A. | 图①中△H2=△H1+△H3 | |
| B. | 图②在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com