

| 1.2g |
| 160g/mol |
| m |
| M |
| 1.2g |
| 160g/mol |
| 1.98g |
| 198g/mol |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④丝织品
A.① B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列有关说法,不正确的是
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
A.仅①③④⑤ B.仅②③④
C.仅①③④ D.仅①②④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO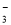 、AlO
、AlO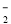 、K+、S2-等离子
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各项中的两个量,其比值一定为2:1的是
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体
B.在碳与浓硫酸的反应中,还原产物与氧化产物的物质的量
C.1mol Na2O2与1molNa2O中的阴离子数目
D.相同温度下,0.2mol/L醋酸溶液和0.1mol/L醋酸溶液中c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知草酸为二元弱酸:
已知草酸为二元弱酸:| A、pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4) |
| B、pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000 |
| C、将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
| D、向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂 |
| B、二氧化氮经过加压凝成无色液体为物理变化 |
| C、Na2O?SiO2是一种简单的硅酸盐,可溶于水 |
| D、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com