
| A. | SO2被酸性高锰酸钾吸收:MnO4-+SO2+4H+═Mn2++SO42-+2H2O | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 氯化镁溶液中加入足量浓氨水 Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | Fe3O4与稀硝酸的反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.沉淀刚好完全时氢氧化钡与硫酸氢铵按照物质的量1:1反应,漏掉了铵根离子与氢氧根离子的反应;
C.氯化镁与浓氨水反应生成氢氧化镁沉淀和氯化铵;
D.稀硝酸具有强氧化性,能够氧化亚铁离子.
解答 解:A.SO2被酸性高锰酸钾吸收,二者发生氧化还原反应,正确的离子方程式为:2MnO4-+3SO2+4H+═2Mn2++3SO42-+2H2O,故A错误;
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全,硫酸氢铵中铵根离子和氢离子都完全反应,正确的离子方程式为:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+H2O+NH3•H2O,故B错误;
C.氯化镁溶液中加入足量浓氨水,反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+,故C正确;
D.Fe3O4与稀硝酸发生氧化还原反应,正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀 | |
| B. | 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用 | |
| C. | H2O2分解产生标准状况下22.4 L O2,理论上转移电子数约为4×6.02×1023 | |
| D. | 常温下pH=3的盐酸与pH=11的某碱溶液等体积混合,若溶液呈碱性,该碱为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液,再加稀HNO3 | 生成白色沉淀,且沉淀不溶解 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、K+ |
| D | 滴加NaOH溶液加热,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | Y的最高价氧化物的水化物具有两性 | |
| B. | Z的最高价氧化物常温常压下为固体 | |
| C. | 气态氢化物的稳定性:X>W>Z | |
| D. | 原子半径:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
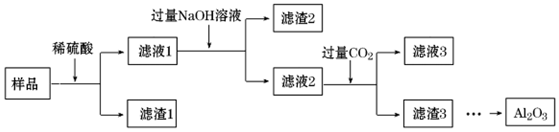
| A. | 滤渣1 的主要成分为SiO2 | |
| B. | 可用KSCN溶液检验滤液1中的Fe 3+ | |
| C. | 滤液2为纯净的Na AlO2溶液 | |
| D. | 将滤渣3 洗涤、干燥、灼烧,可以得到Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
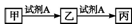
| A. | 若A为氯水,X为金属元素,则甲与丙反应可生成乙 | |
| B. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 | |
| C. | 若A为氧气,丙在通常状况下为红棕色气体,则甲一定为非金属单质 | |
| D. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同压强、同体积的N2O和CO2 | B. | 同体积、同密度的C2H4和C3H6 | ||
| C. | 同温度、同体积的H2和N2 | D. | 同体积、不同密度的N2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
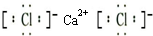 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com