
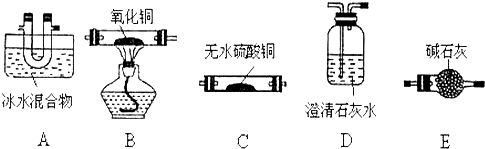
分析 (1)①猜想其产物为CO、CO2和H2O,草酸在100℃时开始升华,157℃时大量升华,并开始分解.草酸钙不溶于水、草酸蒸气能使澄清石灰水变浑浊、草酸蒸气在低温下可冷凝为固体,可知先冷凝挥发出的草酸,再检验水蒸气的生成,检验二氧化碳的生成,并除去二氧化碳,再通过灼热的氧化铜检验一氧化碳气体的存在,利用反应后生成的二氧化碳通入澄清石灰水变浑浊证明一氧化碳的存在;
②CO为可燃性气体,加热之前必须验纯,碱石灰可以吸收草酸分解产生的二氧化碳和水,进而提高CO的浓度,检验产物中CO的实验现象是B中黑色氧化铜变红色,生成了澄清石灰水变浑浊的气体;
③一氧化碳有毒,会污染空气,需要尾气处理装置;
(2)酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色并产生一种气体,得到气体为二氧化碳,MnO4-被还原为Mn2+,结合电子守恒、原子守恒、电荷守恒配平反应的离子方程式.
解答 解:(1)①分解产物为CO、CO2和H2O,检验时应该先用无水硫酸铜检验水蒸气,然后用澄清石灰水检验二氧化碳,最后用加热的CuO和澄清石灰水检验CO,所以仪器的连接顺序为:A→C→D→E→B→D,
故答案为:C;E;
②CO为可燃性气体,加热之前必须验纯,所以在点燃B处酒精灯之前必须验纯,碱石灰可以吸收草酸分解产生的二氧化碳和水,进而提高CO的浓度,当装置B中黑色固体变成红色,且装置D澄清石灰水变浑浊,则证明混合气体中含有CO,
故答案为:收集D处气体,检验CO气体的纯度;除去气体中的CO2 和水,提高CO的浓度;B中黑色固体变红色,D中澄清石灰水变浑浊;
③一氧化碳有毒污染空气,需要尾气处理装置,一氧化碳尾气的处理方法为点燃,操作时将气体通到酒精灯火焰上燃烧,
故答案为:没有CO尾气的处理装置;
(2)酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色并产生一种气体,得到气体为二氧化碳,MnO4-被还原为Mn2+,反应离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O.
点评 本题考查性质实验方案设计,涉及物质性质探究与检验、对装置的分析与评价、氧化还原反应等,明确物质性质及实验操作原理为解答关键,试题有利于提高学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl受热不分解,H2S受热分解 | |
| B. | 往H2S溶液中通入氯气,生成硫和氯化氢 | |
| C. | 与Cu化合时,硫显-2价,氯显-1价 | |
| D. | Cl、S原子的电子层数相同,且Cl原子半径比S原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |

| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=3的1.0LNaHSO3溶液中,含Na+数目为0.001 NA | |
| B. | 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA | |
| C. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| D. | 标准状况下,11.2 L的乙烯中含有的共用电子对数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展的需要 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com