
下列有关仪器刻度位置的叙述正确的是
A.容量瓶容积的刻度线刻在瓶颈上
B.滴定管的“0”标线刻在管的下端
C.托盘天平游码刻度尺的“0”标线刻在尺的右边
D.量筒的最下端刻“0”标线
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
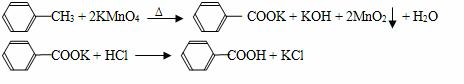
实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
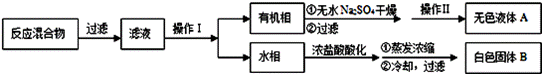
已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,需要用到的主要玻璃仪器为 ;
操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,
现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 |
|
| ① | 将白色固体B加入水中, 加热溶解, | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,
| 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, |
| 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 。(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下图所示装置进行实验,装置正确且设计合理的是
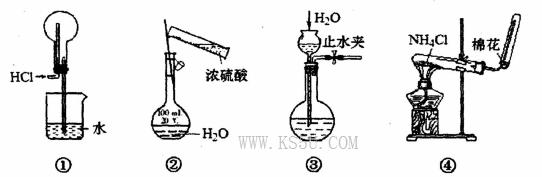
A.用图①所示装置收集HCl气体
B.用图②所示装置配制一定物质的量浓度的硫酸
C.用图③所示装置检查该装置的气密性
D.用图④所示装置进行实验室制取的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作正确的是
A.用过滤法分离氢氧化铁胶体和三氯化铁溶液的混合物
B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线
C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大
D.将金属钠投入到足量CuSO4溶液中,静置后溶液质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的实验装置或操作不能达到实验目的的是
|
|
|
|
| ||
| A.实验室制取氨气 | B.配制100 mL 0.1 mol /L盐酸 | C.测定中和反应的反应热 | D.实验室制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活联系密切,下列说法正确的是
A.常用作净水剂的KAl(SO4)2和漂白粉都是强电解质
B.维生素C具有还原性,在人体内起抗氧化作用
C.对“地沟油”进行分馏可以获得汽油发动机的燃料
D.碘是人体必需的微量元素,所以要多吃富含高碘酸的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端
科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为_________________________________。
(2)沸点:NH3________AsH3(填“>”、“<”或“=”,原因是______________
____________________________________________________________________.
(3)某砷的氧化物俗称“砒霜”,其分子结构如右图所示,该化合物的分子式
为_______________,As原子采取__________________杂化。
(4) H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因_________________________________________________ 。
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式
为_________________;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm,
则每立方厘米该晶体中所含砷元素的质量为____________g(用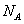 表示阿伏
表示阿伏
 加德罗常数的值)。
加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-==4H2O O2+2H2O+4e-==4OH-
下列说法错误的 ( )
A.氢气通入正极,氧气通入负极
B.燃料电池的能量转化率不能达到100%
C.供电时的总反应为:2H2+O2 ==== 2H2O
D.产物为无污染的水,属于环境友好电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com