
【题目】一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2 , 发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49KJmol﹣1 . 测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( ) 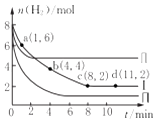
A.该反应在O~8min内的v(CO2)=0.125molL﹣1min﹣1
B.若起始时向容器中充入3mo1CO2和4molH2 , 则平衡时CH3OH的体积分数大于20%
C.若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆)
D.曲线II、曲线III改变条件分别是升高温度、减小压强
【答案】AC
【解析】解:A.由图可知,0~8 min内H2的物质的量变化量为8mol﹣2mol=6mol,故v(H2)= ![]() =0.375 molL﹣1min﹣1 , 速率之比等于其化学计量数之比,故v(CO2)=
=0.375 molL﹣1min﹣1 , 速率之比等于其化学计量数之比,故v(CO2)= ![]() v(H2)=0.125 molL﹣1min﹣1 , 故A正确; B.由图可知,I平衡时氢气为2mol,则:
v(H2)=0.125 molL﹣1min﹣1 , 故A正确; B.由图可知,I平衡时氢气为2mol,则:
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | |
开始(mol) | 6 | 8 | 0 | 0 |
转化(mol) | 2 | 6 | 2 | 2 |
平衡(mol) | 4 | 2 | 2 | 2 |
故I中平衡时甲醇体积分数为 ![]() =20%,若起始时向上述容器中充入3 mol CO2和4 mol H2 , 等效为原平衡压强减小一倍,平衡向逆反应方向移动,甲醇的体积分数减小,即平衡时H2的体积分数小于20%,故B错误;
=20%,若起始时向上述容器中充入3 mol CO2和4 mol H2 , 等效为原平衡压强减小一倍,平衡向逆反应方向移动,甲醇的体积分数减小,即平衡时H2的体积分数小于20%,故B错误;
C.平衡常数K= ![]() =
= ![]() =0.5,此时的浓度商Qc=
=0.5,此时的浓度商Qc= ![]() =0.25<K=0.5,故平衡向正反应方向移动,v(正)>v(逆),故C正确;
=0.25<K=0.5,故平衡向正反应方向移动,v(正)>v(逆),故C正确;
D.与Ⅰ相比,Ⅱ到达平衡时间短,且平衡时氢气浓度大,说明改变条件反应速率加快、反应向逆反应方向移动,若升高温度,反应速率加快,正反应为放热反应,平衡向逆反应方向移动,符合题意;与I相比,Ⅲ到达平衡时间短,且平衡时氢气浓度小,说明改变条件反应速率加快、反应向正反应方向移动,若减小压强,平衡逆向进行氢气的物质的量应增大,不符合题意,故D错误;
故选AC.


科目:高中化学 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“![]() ”和“
”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )

A. 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个
B. ①和②中气体的质量之比为1∶8
C. H2、O2均能发生化合反应,但不能发生置换反应
D. 两容器的温度和压强均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,等质量的CH4 和CO2比较,下列说法中正确的是
A. 密度比4:11 B. 分子数之比为4:11
C. 体积比4:11 D. 物质的量之比为4:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).若反应中生成了标况下22.4L气体,转移的电子数目为________。
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是________(填代号).
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O![]() +2I-=2SO
+2I-=2SO![]() +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为________.证明炉渣中含有FeO的实验现象为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的催化剂和合金材料.请回答:
(1)基态V原子的价层电子排布式为;其中能量最高的电子所占用能级的原子轨道有个伸展方向.
(2)VO2+与  可形成配合物.
可形成配合物.  中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
(3)镍形成的Ni(NH3)62+、Ni(CN)42﹣中,NH3分子中N原子的价层电子对数目为 . 写出一种与CN﹣互为等电子体的分子的化学式: .
(4)La﹣Ni合金是重要的储氢材料,储氢后的晶胞如图所示.①合金中,1个La原子周围距离最近切相等的La原子数目为 . ②含有1molNi原子的合金中储存H2的物质的量为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.08mol气体;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
(已知, ![]() +OH-
+OH-![]() H2O+NH3↑)
H2O+NH3↑)
根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?____________(答是或否)。
(2)由第二份进行的实验得知混合物中应含有____________(填离子符号),其物质的量浓度为____________。
(3)由第三份进行的实验可知12.54g沉淀的成分为____________。
(4)综合上述实验,你认为以下结论正确的是(______)
A.该混合液中一定含有K+、![]() 、
、![]() 、
、![]() ,可能含Cl-,且n(K+)≥0.04mol
,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含K+、Cl-
,可能含K+、Cl-
C.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
D.该混合液中一定含有![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可以表示为FeOCr2O3 , 还含有SiO2、Al2O3杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)过程如图所示. 
已知:CrO42﹣和Cr2O72﹣在酸性条件下可以相互转化.
请回答下列问题:
(1)完成并配平下列方程式: 6FeO+6Cr2O3+KOH+KClO3=K2CrO4+Fe2O3+KCl+
(2)滤渣1的成分是(填化学式),滤液1的成分除K2CrO4、KClO3、KOH外,还含有(填化学式),过滤后洗涤沉淀的操作是 .
(3)试剂1是(填化学式),利用滤渣2可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,电解时阴极的电极反应式为 .
(4)对滤液2用稀硫酸酸化处理时发生的离子反应方程式是 , 酸化处理时往往增大稀硫酸浓度的原因是 .
(5)检验氯酸钾晶体中钾元素的具体方法是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com