
【题目】海洋是资源的宝库,具有十分巨大的开发潜力。工业上从海水提取金属镁的流程如下:
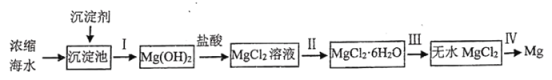
回答下列问题:
(1)沉淀剂是________________(填化学式),不选用同类的其他物质的理由是_______________。
(2)下列选项中,涉及的操作包含操作Ⅰ的是___________。
A 实验室从溴水中提取溴单质
B 除去![]() 固体中的少量NaCl
固体中的少量NaCl
C 从![]() 分解产物中获得
分解产物中获得![]()
D 用工业酒精制无水乙醇
(3)在进行步骤Ⅱ时,如果没有加入盐酸,可能产生的杂质是______________(填化学式)。
(4)一种模拟工业用![]() 制无水
制无水![]() 的实验室设计如下:
的实验室设计如下:
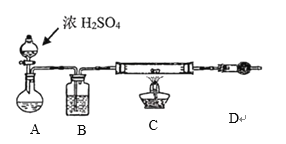
装置A中盛放液体是______________,装置D的作用是____________________________。
(5)步骤Ⅳ发生反应的化学方程式是___________________________________________________。
【答案】Ca(OH)2 Ca(OH)2来源丰富,制造成本低 BC Mg(OH)2或Mg(OH)Cl 浓盐酸 吸收尾气中的HCl,防止空气中的水蒸气进入装置C MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
向海水中加入石灰乳,进行沉淀,沉淀出氢氧化镁,再将氢氧化镁与稀盐酸反应生成氯化镁,在酸性条件下对氯化镁溶液蒸发结晶得到氯化镁晶体,在经过洗涤干燥得到无水氯化镁,电解熔融状态的氯化镁即可得到金属镁。
(1)工业流程中的沉淀剂可用Ca(OH)2,Ca(OH)2来源广泛,资源丰富,制造成本低,可直接从海洋的的贝壳(碳酸钙)煅烧后加水即可得到。
答案为:Ca(OH)2;Ca(OH)2来源丰富,制造成本低;
(2)流程中操作Ⅰ为过滤,
A 实验室从溴水中提取溴单质,利用萃取分液操作,故A错误;
B 除去![]() 固体中的少量NaCl,利用溶解度不同,用少量热水溶解后,降温结晶,过滤,故B正确;
固体中的少量NaCl,利用溶解度不同,用少量热水溶解后,降温结晶,过滤,故B正确;
C 从![]() 分解产物中含有锰酸钾和二氧化锰,锰酸钾可溶而二氧化锰不熔,故获得
分解产物中含有锰酸钾和二氧化锰,锰酸钾可溶而二氧化锰不熔,故获得![]() 的方法为溶解、过滤,故C正确;
的方法为溶解、过滤,故C正确;
D 用工业酒精制无水乙醇用蒸馏的方法,故D错误;
答案选BC。
(3)在进行步骤Ⅱ时,如果没有加入盐酸,氯化镁水解产生Mg(OH)2或Mg(OH)Cl,
答案为:Mg(OH)2或Mg(OH)Cl
(4)该装置利用氯化氢气体在加热的条件下与镁反应制取无水氯化镁,防止氯化镁在溶液中发生水解;装置A中利用难挥发的浓硫酸的脱水性,使浓盐酸挥发出产生氯化氢气体,A盛放液体是浓盐酸,装置D的作用是吸收装置中未反应的氯化氢气体,防止空气中的水分进入C装置;
答案为:浓盐酸;吸收尾气中的HCl,防止空气中的水蒸气进入装置C
(5)制取镁单质,是利用电解熔融氯化镁来生产单质镁。
步骤Ⅳ发生反应的化学方程式是MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。
答案为:MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。


科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450ml和0.5mol/L硫酸溶液500ml。根据这两种溶液的配制情况回答下列问题:
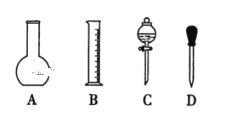
(1)如图所示的仪器中,配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)配制0.1mol/L的NaOH溶液的操作步骤如下,正确的顺序是_______。
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解;
②用少量蒸馏水洗涤烧杯和玻璃棒2~ 3次,每次洗涤的液体都小心转入容量瓶中,并轻轻摇匀;
③继续向容量瓶中加蒸馏水至液面距刻度线1~ 2cm处,改用胶头滴管小心滴加蒸馏水至溶液的凹液面与刻度线相切;
④把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
⑤将容量瓶瓶塞塞紧,充分摇匀。
(3)根据计算,用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度________0.1mol/L(填“大于”“小于”或“等于”,下同)。若还未等溶液冷却就定容,则所得溶液浓度________0.1mol/L。配制好后,发现称量时所用的托盘天平的砝码生锈了________0.1mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是
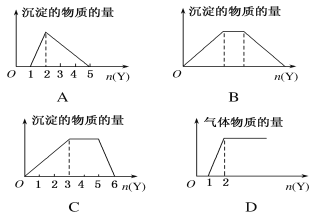
A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
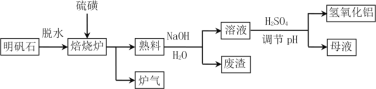
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,为了充分利用资源,一种利用硫铁矿烧渣制绿矾(
等,为了充分利用资源,一种利用硫铁矿烧渣制绿矾(![]() )的化工流程如下:
)的化工流程如下:
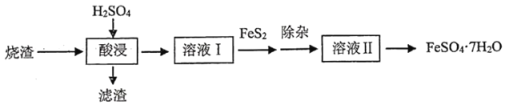
回答下列问题:
(1)酸浸需要使用较浓的硫酸并加热,目的是________________________________,现有![]() ,
,![]() 的硫酸,其物质的量浓度
的硫酸,其物质的量浓度![]() _____________
_____________![]() (保留3位有效数字)。
(保留3位有效数字)。
(2)滤渣除![]() 外,还可能含有__________,溶液Ⅰ需保持
外,还可能含有__________,溶液Ⅰ需保持![]() ,原因是__________。
,原因是__________。
(3)用![]() 还原时,当氧化产物为
还原时,当氧化产物为![]() ,发生主要反应的离子方程式是___________________,检验该反应是否完全发生,所用的试剂是___________________。
,发生主要反应的离子方程式是___________________,检验该反应是否完全发生,所用的试剂是___________________。
(4)除杂时,除去溶液中的![]() ,适宜的物质是_______________。
,适宜的物质是_______________。
A NaOH B H2S C FeS D 氨水
(5)已知![]() ,在不同温度下的溶解度和析出晶体的组成如下表:
,在不同温度下的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 80 | 90 | |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
析出晶体 |
|
|
| |||||||
如要获得![]() ,则需对溶液Ⅱ进行的操作是:蒸发浓缩,___________________,过滤,洗涤,干燥。
,则需对溶液Ⅱ进行的操作是:蒸发浓缩,___________________,过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素均不是稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )

A. 原子半径:W>Z
B. 气态氢化物的稳定性:W>X
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量之比为1:1的Fe、Cu的混合粉末逐渐加入到含1mol![]() 的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
A.14gB.15gC.18gD.22.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
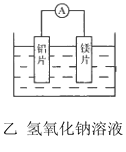
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol L-1的H2SO4溶液中,乙同学将电极放入6mol L-1NaOH的溶液中,如图所示。
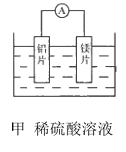
(1)写出甲电池中正极的电极反应式:________.
(2)写出乙电池中总反应的离子方程式:_________.
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出______(填写元素符号,下同)的金属活动性更强,而乙会判断出___的金属活动性更强。
(4)由此实验,可得到如下哪些正确结论(______)
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属活动性不一定比铝的金属活动性强
C.该实验说明金属活动性顺序已过时,已没有使用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)将5.1g镁铝合金溶于60 mL5.0 mol L-1H2SO4溶液中,完全溶解后再加入65mL10.0mol L-1的NaOH溶液,得到沉淀质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入____mLNaOH溶液时,可使溶解在硫酸中的Mg2+和Al3+恰好完全沉淀。
②计算合金溶于硫酸时所产生的氢气在标准状况下为_____L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com