
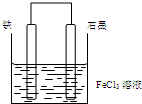
| A. | 电子从石墨棒经外电路流向铁棒 | |
| B. | 总反应为2Fe3++Fe=3 Fe2+ | |
| C. | 石墨电极上发生氧化反应 | |
| D. | 铁电极逐渐变细,石墨电极逐渐变粗 |
分析 因Fe与铁离子可发生Fe+2Fe3+═3Fe2+,形成原电池时,Fe为负极被氧化,C为正极,Fe3+被还原生成Fe2+,电子从负极经外电路流向正极,以此解答该题.
解答 解:A.因Fe与铁离子可发生Fe+2Fe3+═3Fe2+,形成原电池时,Fe为负极被氧化,C为正极,电子从负极经外电路流向正极,即从Fe棒经外电路流向C棒,故A错误;
B.负极是铜失电子发生氧化反应,电极反应为Cu-2e-=Cu2+,正极反应为Fe3++e-=Fe2+,总反应为Fe+2Fe3+═3Fe2+,故B正确;
C.石墨为正极,发生还原反应,故C错误;
D.铁电极为负极被氧化,逐渐变细,石墨电极上是铁离子得电子的过程,产物是亚铁离子,电极质量不变,故D错误.
故选B.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的组成条件、工作原理以及电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:解答题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
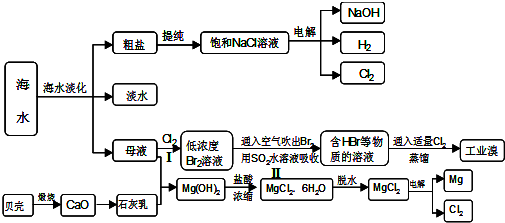
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 通入二氧化碳 | C. | 氢氧化钙溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
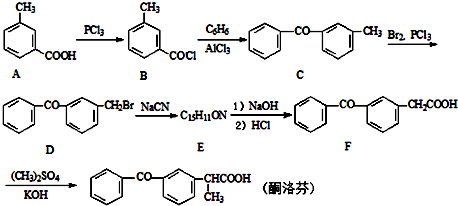
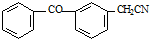 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.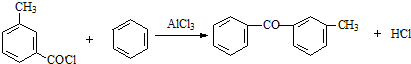 .
. .
.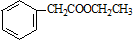 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH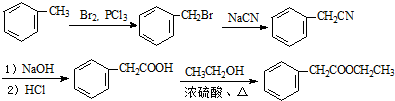 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com