
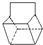
 )是双环戊二烯的一种同分异构体,它的一氯代物有
)是双环戊二烯的一种同分异构体,它的一氯代物有科目:高中化学 来源: 题型:
| A、氨水显碱性:NH3?H2O═NH4++OH- |
| B、Na2S溶液显碱性:S2-+2H2O?H2S+2OH- |
| C、硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42- |
| D、AlCl3溶液显酸性:Al3++3H2O?Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO
| ||
| B、用硫酸铜溶液除去乙炔中的硫化氢气体:Cu2++S2-=CuS↓ | ||
C、乙酸与碳酸钙溶液反应:2CH3COOH+CO
| ||
| D、酸性高锰酸钾溶液中通入乙炔后紫色褪去:2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
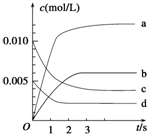 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验方案或者目的 | |
| A | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将产生的气体通入溴的四氯化碳溶液 | 证明溴乙烷发生消去反应 |
| B | 向相同体积的甲苯和苯中加入3滴酸性KMnO4溶液振荡,观察现象 | 证明与苯环相连的甲基易被氧化 |
| C | 将装有NO2的玻璃球浸泡在冷、热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 向碳酸钠固体中加入过量的盐酸,产生的气体通入硅酸钠溶液中,产生白色沉淀 | 证明碳酸的酸性比硅酸强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com