
| A、氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物.金属氧化物不一定是碱性氧化物 |


科目:高中化学 来源: 题型:
| A、溶解的铁粉为2.8g |
| B、原溶液中c(SO42-)=0.5mol/L |
| C、原混合溶液中c(H+)=1.2mol/L |
| D、原溶液中n(NO3-)=0.08mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
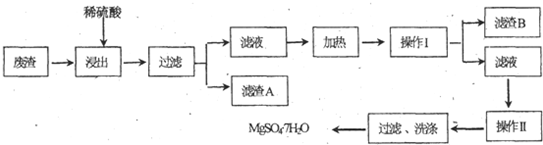

查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定浓度一定体积的盐酸中不断滴加同浓度的NaOH(aq),溶液的pH随NaOH(aq)体积[V(NaOH(aq))]的变化如图所示:则下列有关说法不正确的是( )
在一定浓度一定体积的盐酸中不断滴加同浓度的NaOH(aq),溶液的pH随NaOH(aq)体积[V(NaOH(aq))]的变化如图所示:则下列有关说法不正确的是( )| A、常温下,NaOH(aq)的pH═13 |
| B、b点的溶液中离子浓度大小为:c(Na+)>c(Cl-)>c(OH-)>c(H+),c点的溶液中离子浓度大小为:c(Na+)>c(OH-)>c(Cl-)>c(H+) |
| C、V[NaOH(aq)]>0时的溶液中各离子浓度关系总是:c(Na+)+c(H+)═c(OH-)+c(Cl-) |
| D、常温时,a点的溶液pH═3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
| A、相等物质的量浓度溶液pH关系:pH (NaCN)>pH (Na2CO3)>pH (CH3COONa) |
| B、相等物质的量浓度的HCN和NaCN混合溶液中:c (HCN)+c(H+)=c (OH-)+c (CN-) |
| C、a mol/LHCN与b mol/LNaOH溶液等体积混合后所得的溶液中:若c(Na+)>c (CN-),则a一定小于b |
| D、将Na2CO3加入到HCN溶液中时发生如下反应:Na2CO3+HCN=NaCN+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.6 倍 |
| B、若c(F2):c(ClF):c(ClF3)=1:1:1,则反应一定达到平衡状态 |
| C、达到平衡后,若增大容器容积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D、平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com