
分析 (1)将硝酸、硝酸铁改写为离子形式;
(2)反应中Fe元素化合价由+2价升高为+3价、S元素化合价由-1价升高为0价,N元素化合价由+5价降低为+2价,转移电子数目为3;
(3)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂;
(4)根据N元素化合价变化计算被还原硝酸物质的量,根据N元素计算生成NO物质的量,根据V=nVm计算NO体积.
解答 解:(1)反应FeS2+4HNO3=Fe(NO3)3+2S+NO↑+2H2O改写为离子方程式:FeS2+4H++NO3-=Fe3++2S+NO↑+2H2O,
故答案为:FeS2+4H++NO3-=Fe3++2S+NO↑+2H2O;
(2)反应中Fe元素化合价由+2价升高为+3价、S元素化合价由-1价升高为0价,N元素化合价由+5价降低为+2价,转移电子数目为3,标出电子转移数目与方向为: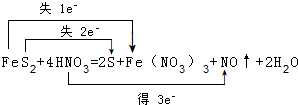 ,
,
故答案为: ;
;
(3)HNO3中N元素化合价由+5价降低为+2价,故HNO3是氧化剂,Fe元素化合价由+2价升高为+3价、S元素化合价由-1价升高为0价,FeS2是还原剂,
故答案为:HNO3;FeS2;
(4)HNO3中N元素化合价由+5价降低为+2价,反应中转移0.3mol电子,被还原的硝酸的物质的量为$\frac{0.3mol}{3}$=0.1mol,根据N元素可知生成NO为0.1mol,标况下NO体积为0.1mol×22.4L/mol=2.24L,
故答案为:0.1mol;2.24.
点评 本题考查氧化还原反应基本概念、计算、电子转移表示以及离子方程式书写,关键是根据元素化合价变化进行分析解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
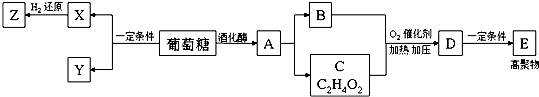
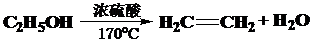 .
.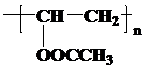 .
.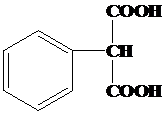 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
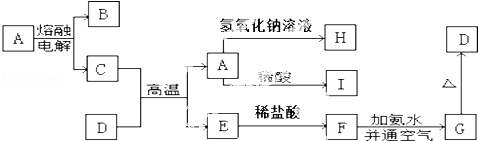
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化工厂生产盐酸的主要过程是:
化工厂生产盐酸的主要过程是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数 d>c>b>a | |
| B. | 单质的还原性D<C<B<A | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 s | B. | 2.5 s | C. | 5 s | D. | 10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
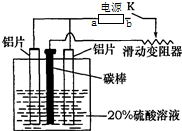 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:
铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com