
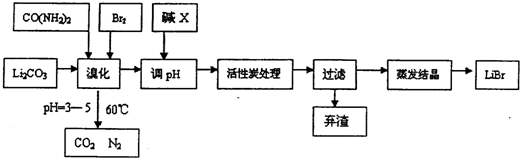
分析 (1)溴化时,pH过小,酸性大,碳酸锂会反应生成CO2;另一方面溴单质和水的反应:Br2+H2O?H++Br-+HBrO,使平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应;
(2)BrO-发生了自身的氧化还原反应,Br元素化合价升高和降低,反应生成BrO3-、Br-;
(3)调节pH溶液时不增加新杂质,根据阳离子是Li+判断碱的化学式;活性炭用于吸附脱色;
(4)由题干信息可知,氨水代与溴、碳酸锂反应生成溴化锂,同时生成水、二氧化碳和氮气,配平书写方程式;
(5)用惰性电极电解熔融碳酸锂可得到金属锂,阳极发生氧化反应,阴离子CO32-放电,碳酸根中氧元素发生氧化反应,反应生成二氧化碳与氧气;
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,因为在图示流程中加入的 LiOH也会生成LiBr,据此不能计算出溴化锂的产率.
解答 解:(1)溴化时,pH过小,酸性大,碳酸锂会反应生成CO2,另一方面溴单质和水的反应:Br2+H2O?H++Br-+HBrO,使平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃,
故答案为:CO2;逆反应方向;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应;
(2)BrO-发生了自身的氧化还原反应,Br元素化合价升高和降低,反应生成BrO3-、Br-,反应离子方程式为:3BrO-=BrO3-+2 Br-,
故答案为:3BrO-=BrO3-+2 Br-;
(3)调节pH溶液时不增加新杂质,阳离子是Li+,故碱是LiOH;活性炭用于吸附脱色,
故答案为:LiOH;吸附脱色;
(4)由题干信息可知,氨水代与溴、碳酸锂反应生成溴化锂,同时生成水、二氧化碳和氮气,反应方程式为:3 Br2+3 Li2CO3+2 NH3.H2O=6LiBr+5 H2O+N2↑+3 CO2↑,
故答案为:3 Br2+3 Li2CO3+2 NH3.H2O=6LiBr+5 H2O+N2↑+3 CO2↑;
(5)用惰性电极电解熔融碳酸锂可得到金属锂,阳极发生氧化反应,阴离子CO32-放电,碳酸根中氧元素发生氧化反应,反应生成二氧化碳与氧气,电极反应式为:2 CO32--4 e-=O2↑+2CO2↑,
故答案为:2 CO32--4 e-=O2↑+2CO2↑;
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,因为在图示流程中加入的 LiOH也会生成LiBr,据此不能计算出溴化锂的产率,
故答案为:不能,因为在图示流程中加入的 LiOH也会生成LiBr.
点评 本题考查化学工艺流程、物质的分离提纯、对实验条件的分析评价、电极反应式书写等,(5)中电极反应式书写为易错点,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
 ,反应类型为加聚反应.
,反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
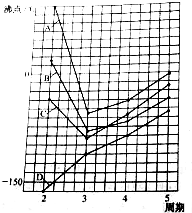 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
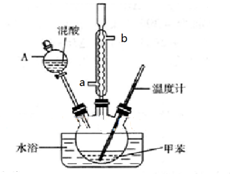
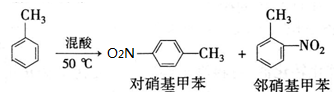
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液体烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2Ag+(aq)+Cd(s)=2Ag(s)+Cd 2+(aq) | B. | Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq) | ||
| C. | 2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) | D. | 2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com