
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
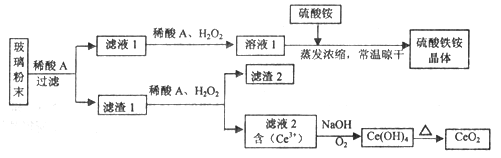
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
【答案】 H2SO4 使Fe2+氧化为Fe3+ 取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+。或其他合理答案 Fe2+ +2FeO(OH) === Fe3O4 +2H+ 4Ce 3 ++ O2 +12OH-+2H2O ==4Ce(OH)4↓ Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,酸性废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 0.98或98%
Fe(OH)3 + 3H+,酸性废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 0.98或98%
【解析】已知CeO2不溶于稀硫酸,也不溶于NaOH溶液,因此玻璃粉末溶于稀硫酸中氧化铁、氧化亚铁溶解得到滤液1,加入双氧水将硫酸亚铁氧化为硫酸铁,然后加入硫酸铵通过蒸发浓缩即可得硫酸铁铵晶体到;二氧化硅和二氧化铈不溶,即滤渣1是二氧化硅和二氧化铈,加入稀硫酸和双氧水,得到Ce3+的溶液,说明二氧化铈和双氧水发生了氧化还原反应,滤渣2是二氧化硅。滤液2中加入氢氧化钠并通入氧气生成Ce(OH)4,加热分解得到二氧化硅。
(1)根据以上分析可知稀酸A是硫酸,的分子式是 H2SO4;(2)滤液1中含有亚铁离子,加入H2O2溶液的目的是使Fe2+氧化为Fe3+;(3)亚铁离子能与铁氰化钾溶液反应产生蓝色沉淀,因此证明滤液1中含有亚铁离子的实验操作是:取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+;(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,根据电子得失守恒和原子守恒可知该反应的离子方程式为Fe2++2FeO(OH)=Fe3O4 +2H+;(5)由滤液2生成Ce(OH)4的反应物是氢氧化钠、氧气和Ce3+,因此反应的离子方程式为4Ce3++ O2 +12OH-+2H2O=4Ce(OH)4↓;(6)由于Fe3++3H2O![]() Fe(OH)3 + 3H+,酸性溶液中氢离子浓度大,废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体,所以效率会降低;(7)根据电子得失守恒可知
Fe(OH)3 + 3H+,酸性溶液中氢离子浓度大,废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体,所以效率会降低;(7)根据电子得失守恒可知
Ce(OH)4 ~~~~FeSO4
0.0025mol 0.1000mol/L×0.025L
所以m[Ce(OH)4 ]=0.0025mol×208g/mol=0.52g,产品中Ce(OH)4 的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为 (填写数值)。
(2)将FeCl3 溶液与NaHCO3 溶液混合,其离子方程式为 。
(3)25℃时pH=3的溶液中,c(Fe3+)= molL-1。
(4)FeCl3 在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3 =CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q、r,t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol·L-1的v溶液中:c(OH-)/c(H+)=1.0×1010。上述物质的转化关系如图所示。下列说法正确的是
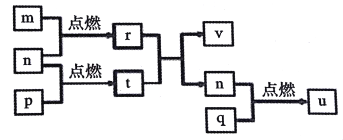
A. 原子半径的大小:W>Z>Y>X
B. Z分别与Y、W组成的化合物中化学键类型可能相同
C. v能抑制水的电离而u能促进水的电离
D. 粘有q的试管可用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒中含辣椒素,局部应用可助减轻疼痛。辣椒素酯类化合物的结构可以表示为: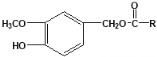 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:

已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G中含有的官能团有 、 。
(2)由C生成D的反应类型为 ,D的化学名称为 。
(3)①的化学方程式为 。
(4)J的结构简式为 。
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;丫与M形成的气态化合物在标准状况下的密度为0.76g·L-1; W的质子数是X、Y、Z、M四种元素质子数之和的![]() ,下列说法正确的是
,下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. YZ2溶于水形成的溶液具有较强的氧化性
C. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
D. 1 molWM溶于足量水中完全反应共转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
碳 | 氮 | Y | |
X | 硫 | Z |
请回答下列问题:
(1)Z元素在周期表中的位置为________________。
(2)表中元素原子半径最大的是(写元素符号)________________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是________(填序号)。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)现有一定量的铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1 NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________________________,生成硫酸铜物质的量为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 把煤作为燃料可通过下列两种途径:
途径I:直接燃烧C(s)+O2(g)═CO2(g)(放热Q1kJ)
途径II:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)(吸热Q2kJ)
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)
2H2(g)+O2(g)═2H2O(g)(共放热Q3kJ)
试回答下列问题:
①判断两种途径放出热量大小:途径I ______(填“大于”、“等于”或“小于”)途径II
②Q 1、Q 2 、Q 3 的数学关系式是________________________。
③已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。
其他相关数据如下表:则表中x的值为_____________。
O===O | H—H | H—O(g) | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
④简述煤通过途径Ⅱ作为燃料的意义:______________________________

(2)化学反应可视为旧键断裂和新键形成的过程。如图为白磷(P4)和P4O6分子的分子结构示意图,其他相关数据如下表所示。则反应P4 +3O2 = P4O6的热量变化为:__________________。
O===O | P—P | P—O | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 198 | 360 |
(3)下列变化中属于放热反应的是______
A.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
B.镁条与二氧化碳反应
C.干冰升华为气体
D.碳酸钙高温锻烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究碳酸钙与稀盐酸反应过程中的速率变化,在VmL稀盐酸中加入足量的碳酸钙,收集反应放出的CO2(气体体积已换算为标准状况下的数值),实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
CO2体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)0~1 min、1~2 min、2~3 min、3~4 min、4~5 min五个时间段中,_________反应速率最快。
(2)假设溶液体积不变,4~5min时间段以盐酸的浓度变化来表示的该反应速率为____________________________。
(3)为了降低上述化学反应的反应速率,向溶液中加入下列物质,你认为可行的是
_______________(填编号)。
a.蒸馏水 b.浓盐酸 c.NaCl固体 d.NaCl溶液
(4)除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?(试写两条)_______________________________________________________________________,
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,相同体积的四个刚性容器中分别存在以下四个平衡:
①N2(g)+3H2(g)![]() 2NH3(g) K1
2NH3(g) K1
②H2(g)+I2(g)![]() 2HI(g) K2
2HI(g) K2
③2NO2(g)![]() N2O4(g) K3
N2O4(g) K3
④C(s)+H2O(g)![]() CO(g)+H2(g) K4
CO(g)+H2(g) K4
请完成下列各题:
(1)写出反应④的平衡常数的表达式K4=____________;
(2)现有相同温度下的以下平衡:
⑤ 2N2(g)+6H2(g)![]() 4NH3(g) K5
4NH3(g) K5
⑥2HI(g)![]() H2(g)+I2(g) K6
H2(g)+I2(g) K6
则K5=__ ;K6=_ ;(用K1、K2、K3、K4表示)
(3)若平衡③中NO2的体积分数为a,某时刻再加入一定量的N2O4,此时υ(正) υ(逆);再次达到平衡后,NO2的体积分数 a。(填“﹥”、“﹤”或“﹦”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com