
【题目】I.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出上述反应的平衡常数表达式______。
(2)①结合表中数据,判断该反应的ΔH____0(填“>”或“<”),理由是_____
②判断该反应达到平衡的依据是_____。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
II.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
| <>H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是____。
、ClO-、S2-中结合H+的能力最弱的是____。
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)/c(OH-) D.c(OH-)
(3)0.1mol·L-1的H2C2O4溶液与0.1mol·L-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_____。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK___NaClO,两溶液中:c(Na+)-c(ClO-)___c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(5)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=____。
【答案】![]() > 计算700℃和800℃的平衡常数K1<K2,所以ΔH>0 AB
> 计算700℃和800℃的平衡常数K1<K2,所以ΔH>0 AB ![]() AC c(K+)>c(
AC c(K+)>c(![]() )>c(H+)>c(C2O42-)>c(OH-) > = 5
)>c(H+)>c(C2O42-)>c(OH-) > = 5
【解析】
I.(1)由方程式可知,该反应的化学平衡常数K为![]() ;
;
(2)①建立三段式计算700℃和800℃的平衡常数,比较平衡常数的大小,判断平衡移动方向;
②化学平衡的标志是正逆反应速率相同,各组分浓度保持不变;
II.(1) 电离平衡常数越大,酸性越强,酸越强其对应酸根离子结合氢离子能力越弱;
(2)醋酸为弱酸,稀释过程中醋酸的电离程度增大,溶液中氢离子、醋酸根离子的物质的量增大,醋酸的物质的量减小,由于溶液体积变化程度更大,则溶液中氢离子、醋酸根离子、醋酸的浓度减小;由于水的离子积不变,则溶液中氢氧根离子浓度增大;
(3)0.1mol·L-1的H2C2O4溶液与0.1mol·L-1的KOH的溶液等体积混合,反应生成KHC2O4,KHC2O4溶液呈酸性,说明溶液中HC2O4-电离大于水解;
(4)根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK;
(5)依据醋酸的电离平衡常数和题给数据计算可得。
I.(1)由方程式可知,该反应的化学平衡常数K为![]() ;
;
(2)①由题意建立700℃时平衡三段式如下:
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起(mol/L) 0.2 0 0
变(mol/L) 0.09 0.045 0.045
平(mol/L) 0.11 0.045 0.045
化学平衡常数K1=![]() =
=![]() ≈0.17
≈0.17
由题意建立800℃时平衡三段式如下:
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起(mol/L) 0.12 0 0
变(mol/L) 0.08 0.04 0.04
平(mol/L) 0.04 0.04 0.04
化学平衡常数K2=![]() =
=![]() =1
=1
由计算结果可知,700℃时平衡常数K1小于800℃的平衡常数K2,说明升高温度,平衡向正反应方向移动,则该反应为吸热反应,ΔH>0,故答案为:ΔH>0;计算700℃和800℃的平衡常数K1<K2,所以ΔH>0;
②A、C为固体,该反应是一个气体质量增大的反应,恒容密闭容器中混合气体的密度保持不变,说明气体的质量不变,能说明反应达平衡状态;
B、容器内各气体浓度恒定,说明正逆反应速率相等,能说明反应达平衡状态;
C、该反应是一个气体体积不变的反应,容器内压强始终保持不变,不能说明反应达平衡状态;
D、2υ正(NO)=υ逆(N2),NO、N2表示的正、逆反应速率之比不等于计量数之比,说明反应没有达到平衡状态;
故答案为:AB;
II.(1)根据表中数据可知,酸的电离出平衡常数大小为:H2C2O4> HC2O4—>CH3COOH>H2CO3> H2S > HClO >HCO3->HS—,电离平衡常数越大,酸性越强,所以酸性由强到弱的顺序为:H2C2O4> HC2O4—>CH3COOH>H2CO3> H2S > HClO >HCO3->HS—,酸越强其对应酸根离子结合氢离子能力越弱,则结合H+的能力最弱的是HC2O4—,故答案为:HC2O4—;
(2)A、醋酸为弱酸,稀释过程中醋酸的电离程度增大,溶液中H+离子物质的量增大, c(H+)减小,故符合题意;
B、醋酸的电离常数Ka=![]() ,则
,则![]() =
=![]() ,醋酸稀释过程中,温度不变电离常数不变,醋酸根浓度减小,
,醋酸稀释过程中,温度不变电离常数不变,醋酸根浓度减小,![]() 增大,则
增大,则![]() 增大,故不符合题意;
增大,故不符合题意;
C、水的离子积常数Kw=c(H+)c(OH-),醋酸稀释过程中,温度不变水的离子积常数不变,c(H+)减小,c(OH-)增大,则![]() 减小,故符合题意;
减小,故符合题意;
D、水的离子积常数Kw=c(H+)c(OH-),醋酸稀释过程中,温度不变水的离子积常数不变,c(H+)减小,c(OH-)增大,故不符合题意;
故答案为:AC;
(3)0.1mol·L-1的H2C2O4溶液与0.1mol·L-1的KOH的溶液等体积混合,反应生成KHC2O4,KHC2O4溶液呈酸性,说明溶液中HC2O4-电离大于水解,则c(H+)>c(OH-),溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK,所以pH相同时CH3COOK的浓度大于NaClO;由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:c(Na+)-c(ClO-)= c(K+)-c(CH3COO-),故答案为:>;=;
(5)醋酸的电离平衡常数Ka=![]() = 1.8×10-5,溶液中c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×
= 1.8×10-5,溶液中c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×![]() =1.8×10-5×
=1.8×10-5×![]() = 1×10-5mol/L,则该溶液的pH=5,故答案为:5。
= 1×10-5mol/L,则该溶液的pH=5,故答案为:5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使酸性KMnO4溶液褪色。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是()
A. CH![]() C-CH3B.
C-CH3B. ![]() C. CH2=CHCH3D.
C. CH2=CHCH3D. 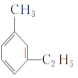
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室中四个装置的说明符合实验要求的是
A.若需制备较多量的乙炔可用此装置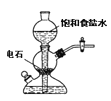
B.可用此装置来制备硝基苯,但产物中可能会混有酸
C.可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘
D.可用此装置来制备乙酸乙酯并在烧瓶中获得产物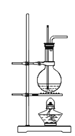
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:

(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子的浓度为( )。
A.0.1(b-2a) mol·L-1B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1D.10(b-2a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I、 SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成。
根据上述实验,下列说法正确的是()
A.根据实验①只能确定原溶液中一定有![]() ,没有Fe2+
,没有Fe2+
B.取实验②后的溶液滴加淀粉溶液变蓝色
C.原溶液中可能含有NH4+、Na+、SO32-、I四种离子
D.取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH—Cl键放出431kJ能量。该条件下H2+Cl2![]() 2HCl反应中的能量变化可用如图表示:
2HCl反应中的能量变化可用如图表示:

现有1molH2和1molCl2在25℃、101kPa下完全反应。请根据上述信息回答下列有关问题:
(1)反应物断键吸收的总能量为___。
(2)生成物成键放出的总能量为___。
(3)H2+Cl2![]() 2HCl是___(填“吸热”或“放热”)反应。
2HCl是___(填“吸热”或“放热”)反应。
(4)反应物的总能量___(填“>”或“<”)生成物的总能量。
(5)写出盐酸与氢氧化铝反应的离子方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com