
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,则△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ•mol-1 |
分析 A.反应的热效应只与始态、终态有关,与过程无关;
B.依据中和热概念分析可知,只有强酸和强碱的稀溶液中和生成1mol水时且无沉淀生成,放出的热量才相同;
C.△H=Q(生成物能量和)-Q(反应物能量和),水蒸气比液体水能量高;
D.依据热化学方程式和盖斯定律计算①-②的结果分析判断.
解答 解:A.反应的热效应只与始态、终态有关,与过程无关,所以同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故A正确;
B.弱酸弱碱没有完全电离,电离时需吸收能量,中和生成1mol水时放出的热量少,强酸强碱稀溶液反应生成1mol水同时生成沉淀,放出热量会增大,故B错误;
C.△H=Q(生成物能量和)-Q(反应物能量和),水蒸气比液体水能量高,所以生成液态水放出的热量多,焓变为负值,则△H1>△H2,故C错误;
D.①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,盖斯定律计算①-②得到,C(s,石墨)=C(s,金刚石)△H=+1.5 kJ•mol-1,故D错误;
故选A.
点评 本题考查化学反应中能量的变化以及焓变的意义,盖斯定律计算和中和热概念实质理解,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 | |
| B. | NaHCO3俗称小苏打,Na2CO3俗称苏打或纯碱 | |
| C. | Na2CO3很稳定,而NaHCO3受热时容易分解 | |
| D. | 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
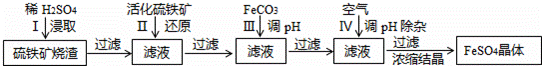
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,把上层液体从分液漏斗上口倒出 | |
| C. | 不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭 | |
| D. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体放入烧杯中溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com