

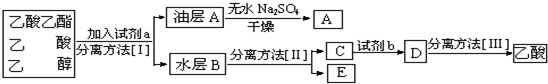
分析 (1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(2)导管伸入液面下可能发生倒吸;
(3)进行该实验时,乙酸、乙醇沸点低,易暴沸,加入少量碎瓷片,目的是防暴沸;
(4)产率很低的原因有:乙酸和乙醇容易挥发,温度过高原料来不及反应就被蒸出;
(5)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
(6)根据NaOH能与酸、酯发生反应以及NaOH量的不同反应进行的程度不同进行解答;
(7)图乙改进实验装置,a装置的优点是使乙酸和乙醇冷却,回到容器中继续反应,提高反应物利用率.
解答 解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应:CH3COOH+H18OCH2CH3 CH3CO18OCH2CH3+H2O,生成乙酸乙酯和水,
CH3CO18OCH2CH3+H2O,生成乙酸乙酯和水,
浓硫酸作催化剂,加快反应速率,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,增加乙酸乙酯产率,
故答案为:浓硫酸作催化剂,加快反应速率;浓硫酸作吸水剂,吸收反应生成的水,使平衡右移,增加乙酸乙酯产率;
(2)试管受热不均,右端试管中的导管伸入液面下可能发生倒吸,导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止碳酸钠液体倒吸,便于乙酸乙酯流出,
故答案为:防倒吸;
(3)乙酸、乙醇沸点低,易暴沸,碎瓷片表面多孔,能引入汽化中心,防止液体暴沸,
故答案为:防暴沸;
(4)该反应放热,乙酸、乙醇都易挥发,温度升高,乙酸和乙醇不断挥发,使乙酸乙酯产率降低,
故答案为:该反应放热,乙酸和乙醇不断挥发,反应物利用率下降,故乙酸乙酯产率降低;
(5)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可;乙酸钠与乙醇分离采用蒸馏,分离方法Ⅱ是蒸馏,应该使用硫酸将乙酸钠转化成乙酸,然后通过蒸馏将乙酸分离,
故答案为:饱和Na2CO3溶液;分液;蒸馏;浓硫酸;蒸馏;
(6)①甲得到了不溶于水的中性酯,没有酸,说明所加NaOH溶液恰好中和了过量的酸;
②乙得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应;
③丙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,
故答案为:①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯 ②乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物 ③丙同学加入的碱过量使生成的酯已经水解为可溶性的醇和钠盐;
(7)a装置为冷凝管,能使乙酸和乙醇冷却,回到容器中继续反应,提高反应物利用率,
故答案为:使乙酸和乙醇冷却,回到容器中继续反应,提高反应物利用率.
点评 本题考查了乙酸乙酯的制备方法及实验方案的设计与评价,题目难度中等,注意掌握乙酸乙酯的反应原理及实验室制法,明确正确的实验操作方法及浓硫酸、饱和碳酸钠溶液的作用为解答本题的关键,试题有利于提高学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电能与化学能之间的转化具有重要的使用价值.
电能与化学能之间的转化具有重要的使用价值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 (25℃) | Ka=1.75ⅹ10-5 | Ka=2.98ⅹ10-8 | Ka1=4.3ⅹ10-7 Ka2=5.61ⅹ10-11 | Ka1=1.54ⅹ10-2 Ka2=1.02ⅹ10-7 |
| A. | 少量的CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:n (HCl)=1 mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 | |
| B. | 图2:n (NaOH)=1 mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| C. | 图3:n (O2)=1 mol,高温下C和O2在密闭容器中的反应产物 | |
| D. | 图4:n (HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com