
 ��D �Ļ�ѧ����Ϊ����Ȳ��
��D �Ļ�ѧ����Ϊ����Ȳ�� ����1mol E�ϳ�1��4-���������飬��������Ҫ��������4mol��
����1mol E�ϳ�1��4-���������飬��������Ҫ��������4mol��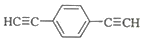 ��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪn
��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪn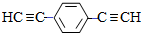 $\stackrel{����}{��}$
$\stackrel{����}{��}$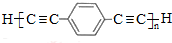 +��n-1��H2��
+��n-1��H2��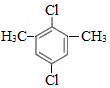 ��
�� ��
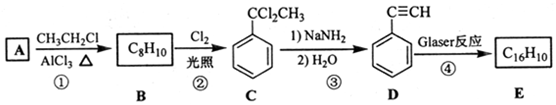
�� ���� ��B�ķ���ʽ��C�Ľṹ��ʽ��֪BΪ ����A�������鷢��ȡ����Ӧ����B����AΪ
����A�������鷢��ȡ����Ӧ����B����AΪ ���Ա�C��D�Ľṹ��֪C��ȥ2����HCl��ͬʱ�γ�̼̼�����õ�D���÷�Ӧ������ȥ��Ӧ��D������Ϣ�е�ż����Ӧ����EΪ
���Ա�C��D�Ľṹ��֪C��ȥ2����HCl��ͬʱ�γ�̼̼�����õ�D���÷�Ӧ������ȥ��Ӧ��D������Ϣ�е�ż����Ӧ����EΪ ���ݴ˷������
���ݴ˷������
��� �⣺��1���������Ϸ�����B�Ľṹ��ʽΪ ��D�Ļ�ѧ����Ϊ����Ȳ��
��D�Ļ�ѧ����Ϊ����Ȳ��
�ʴ�Ϊ�� ������Ȳ��
������Ȳ��
��2���������Ϸ�������ΪA�������鷢��ȡ����Ӧ����B����ΪC��ȥ2����HCl������ȥ��Ӧ����̼̼�����õ�D��
�ʴ�Ϊ��ȡ����Ӧ����ȥ��Ӧ��
��3��E�Ľṹ��ʽΪ ����1mol E�ϳ�1��4-���������飬̼̼���������������ӳɷ�Ӧ����������Ҫ��������4mol��
����1mol E�ϳ�1��4-���������飬̼̼���������������ӳɷ�Ӧ����������Ҫ��������4mol��
�ʴ�Ϊ�� ��4��
��4��
��4������� ��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ��n
��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ��n $\stackrel{����}{��}$
$\stackrel{����}{��}$ +��n-1��H2��
+��n-1��H2��
�ʴ�Ϊ��n $\stackrel{����}{��}$
$\stackrel{����}{��}$ +��n-1��H2��
+��n-1��H2��
��5�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3��1�����ܵĽṹ��ʽΪ��

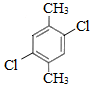
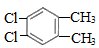
 ������2�֣�
������2�֣�
�ʴ�Ϊ�� ��
�� ��
��
���� ���⿼���л�����ƶ���ϳɡ��л���Ӧ���͡���������ͬ���칹����д������Ϣ�Ļ�ȡ��Ǩ�����õȣ��Ƕ��л���ѧ�������ۺϿ��飬���л���ѧ�������ͣ��������չ����ŵ�������ת����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʣ�����������ͭ����� | B�� | ԭ����������ͭ��������12.4g | ||
| C�� | ��Ӧ����Һ��n��Fe3+��=0.10mol | D�� | ��Ӧ����Һ��n��Fe2+��+N��Cu2+��=1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӻ�����8�����ӵ�̼ԭ��${\;}_{8}^{14}$C | |
| B�� | ����Ļ�ѧʽ��FeO | |
| C�� | NH4Cl�ĵ���ʽΪ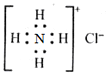 | |
| D�� | Ca2+�Ľṹʾ��ͼΪ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 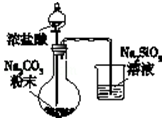 ��֤���ԣ�H2CO3��H2SiO3 | |
| B�� |  ���ڷ���CCl4��ȡ��ˮ����л����ˮ�� | |
| C�� | 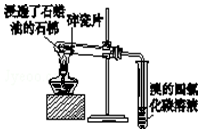 ֤��ʯ���ͷֽ����ɵ���������ϩ | |
| D�� | 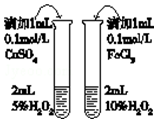 �Ƚϲ�ͬ�����Է�Ӧ���ʵ�Ӱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������������Ӧ��SO42-+Ba2+�TBaSO4�� | |
| B�� | �������пƬ�ϣ�Zn+2H+=Zn2++H2�� | |
| C�� | ����������Һ�м������������Һ��Fe2++2H2O2+4H+=Fe3++4H2O | |
| D�� | �Ȼ�����Һ�мӹ�����ˮ��Al3++3NH3•H2O=Al ��OH��3��+3NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
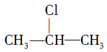 +NaOH$��_{��}^{��}$CH3-CH�TCH2+NaCl+H2O��
+NaOH$��_{��}^{��}$CH3-CH�TCH2+NaCl+H2O��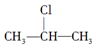 $��_{-NaCl��-H_{2}O}^{NaOH��������}$CH3-CH�TCH2�����Ǽ����л��������ת����ϵ��
$��_{-NaCl��-H_{2}O}^{NaOH��������}$CH3-CH�TCH2�����Ǽ����л��������ת����ϵ��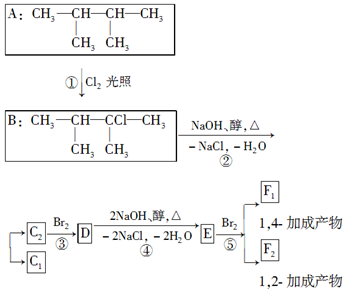
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com