
分析 (1)Na、Na2O的混合物及Al加入水中发生的反应为2Na+2H2O=2NaOH+H2↑、Na2O+H2O=2NaOH、2NaOH+2Al+2H2O=2NaAlO2+3H2↑,发生的反应中Na、Al失电子,H元素电子生成氢气,根据转移电子守恒计算Na的物质的量,再结合钠和氧化钠混合物的质量结合原子守恒计算被氧化Na的质量;
(2)先根据氢氧化钠、铝的物质的量之间关系确定溶液中溶质,根据溶液质量、密度计算溶液体积,再利用物质的量浓度公式计算所得溶液物质的量浓度.
解答 解:(1)Na、Na2O的混合物及Al加入水中发生的反应为2Na+2H2O=2NaOH+H2↑、Na2O+H2O=2NaOH、2NaOH+2Al+2H2O=2NaAlO2+3H2↑,发生的反应中Na、Al失电子,H元素电子生成氢气,根据转移电子守恒等n(Na)=$\frac{\frac{15.68L}{22.4L/mol}×2-\frac{10.8g}{27g/mol}×3}{1}$=0.2mol,m(Na)=0.2mol×23g/mol=4.6g,n(Na2O)=$\frac{10.8g-4.6g}{62g/mol}$=0.1mol,根据Na原子守恒得被氧化n(Na)=2n(Na2O)=0.2mol,
被氧化m(Na)=0.2mol×23g/mol=4.6g,
答:被氧化钠的质量为4.6g;
(2)根据Na原子守恒得n(NaOH)=n(Na)=0.4mol,n(Al)=$\frac{10.8g}{27g/mol}$=0.4mol,根据 2NaOH+2Al+2H2O=2NaAlO2+3H2↑知,氢氧化钠和铝恰好完全反应,所以
完全反应后溶液中的溶质为NaAlO2,溶质的n(NaAlO2)=n(Na)=0.4mol,溶液体积=$\frac{10.8g×2+263.8g-\frac{15.68L}{22.4L/mol}×2g/mol}{1.42g/mL}$=200mL=0.2L,c(NaAlO2)=$\frac{0.4mol}{0.2L}$=2mol/L,
答:所得溶液的物质的量浓度是2mol/L.
点评 本题考查根据方程式的有关计算,为高频考点,侧重考查学生分析计算能力,注意结合原子守恒及转移电子守恒来计算,(2)题确定溶液中溶质成分是解本题难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 青苹果只含淀粉不含糖类 | B. | 熟苹果中只含葡萄糖不含淀粉 | ||
| C. | 苹果转熟时葡萄糖合成淀粉 | D. | 苹果转熟时淀粉水解为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
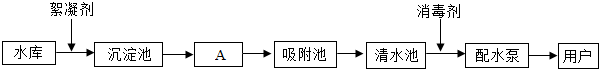
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过煤的直接或间接液化可以获得各种芳香烃 | |
| B. | 通过石油的催化重整等工艺可获取芳香烃 | |
| C. | 石油的裂化的目的主要是为了提高轻质油的产量 | |
| D. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 NaOH溶液 | B. | 2 mol•L-1HCl溶液 | ||
| C. | 3 mol•L-1 NaCl溶液 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应 2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 石灰石与醋酸溶液反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 溴化亚铁溶液中通入少量氯气2Br-+Cl2═Br2+2C1- | |
| D. | NH4HCO3溶液中加入足量的NaOH溶液:NH+4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )
如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )| A. | 甲、乙、丙都属于氧化还原反应 | |
| B. | 甲反应的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | 丙充分反应,能产生0.05 mol O2,转移电子0.1 mol | |
| D. | 甲、乙、丙充分反应后所得溶液的物质的量浓度为C1、C2、C3,则C1=C2=C3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com