
硫酸钙可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是
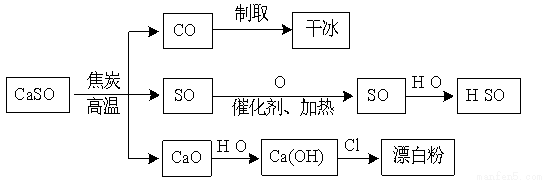
A.CO2制取干冰的过程吸收热量,属于物理变化
B.硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2
C.由SO2制取H2SO4的过程均为氧化还原反应
D.石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
化学与能源、环境、生产、生活密切相关。下列说法不正确的是
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.可利用工业生产产生的二氧化碳制造全降解塑料
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
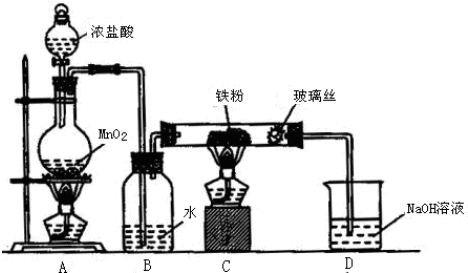
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(C2O42-)<0.64c(CO32-) | B. | c(CO32-)>1.56c(C2O42-) | ||
| C. | c(C2O42-)<1.56c(CO32-) | D. | c(C2O42-)>0.64c(CO32-) |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:计算题
黄钠铁矾[NaaFeb(SO4)c(OH)d]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去铁。为测定黄钠铁矾的组成,该小组进行了如下实验:
①称取12.125 g样品,加盐酸完全溶解后,配成250.00 mL溶液A。
②量取25.00 mL溶液A,加入足量的KI,再用0.2500 mol·L-1 Na2S2O3溶液滴定生成的I2(反应原理为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mL Na2S2O3溶液至终点。
③另取50.00 mL溶液A,加入足量BaCl2溶液充分反应后,过滤,将所得沉淀洗涤、干燥后,称得其质量为2.330 g。
(1)NaaFeb(SO4)c(OH)d中a、b、c、d之间的代数关系式为 。
(2)通过计算确定黄钠铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) ΔH1=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g) ΔH2=+27.6 kJ·mol-1
则下列说法正确的是
A.升高a的反应温度,乙醇的转化率增大
B.由b可知:乙醇的燃烧热为13.8 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(g) ΔH=+485.6 kJ·mol-1
D.制取等量的氢气,途径b消耗的能量更多
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是
A.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污
B.铝易发生钝化,可用于作飞机、火箭的结构材料
C.炭具有还原性,可用于冶炼钠、镁、铝等金属
D.浓硫酸具有强氧化性,可用于干燥二氧化硫气体
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
| N(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
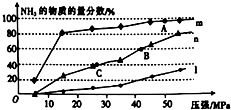
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
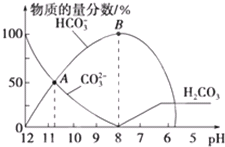
| A. | 当溶液的pH=7时,溶液的总体积为20mL(若忽略溶液混合后体积的变化) | |
| B. | 在0.1mol/L 的Na2CO3溶液中:c(Na+)+c(H+)═c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | 在A点所示的溶液中:c(CO32-)═c(HCO3-)>c(H+)>c(OH-) | |
| D. | 在B点所示的溶液中,浓度最大的阳离子是Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com