
| A. | N60与N2都是氮的同素异形体 | |
| B. | N60转化为N2属化学变化 | |
| C. | N60的总能量高于N2的总能量 | |
| D. | N60变为 N2的反应是放热反应,说明N60比N2更稳定 |
分析 A.同素异形体是指由同种元素组成的不同单质;
B.判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化;
C.放热反应反应物能量高于生成物;
D.能量越低越稳定.
解答 解:A.N60与N2是同种元素组成的不同单质,属同素异形体,故A正确;
B.N60 转化为N2有新物质生成,是化学变化,故B正确;
C.N60变成 N2时放出巨大能量,说明变化过程为放热反应,N60的总能量高于N2的总能量,故C正确;
D.N60变为 N2的反应是放热反应,说明N2比N60能量低,更稳定,故D错误.
故选D.
点评 本题考查同素异形体、化学变化、高分子化合物和放热反应等,难度不大,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.


科目:高中化学 来源: 题型:选择题

| A. | 用浓硫酸和Cu制取SO2 | B. | 用浓盐酸和MnO2制取Cl2 | ||
| C. | 用过氧化氢和二氧化锰制取O2 | D. | 用NH4C1溶液和Ca(OH)2制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在已知碱金属元素中具有最大的原子半径 | |
| B. | 其氧化物对应的水化物是极强的碱 | |
| C. | 在空气中燃烧时生成氧化物Fr2O | |
| D. | 在已知碱金属元素单质中熔点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
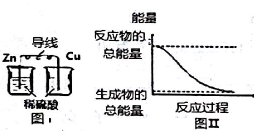
| A. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| B. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图Ⅱ所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com