
����Ŀ��ͼa��1 mol NO2��1 mol COǡ�÷�Ӧ����CO2��NO�����е������仯ʾ��ͼ����������̶����ܱ�������ͨ������ʵ�����NO2 ��CO����Ӧ�е�CO��NO��Ũ����ʱ��仯��ʾ��ͼ��bͼ������ͼ��ش��������⣺
a  b
b
(1)д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ_____________________________________��
(2)�ӷ�Ӧ��ʼ��ƽ�⣬��NO2Ũ�ȱ仯��ʾƽ����Ӧ����v(NO2)��_____________��
(3)���¶��¸÷�Ӧ��ƽ�ⳣ��K=___________��
(4)830Kʱ�����ܱ������з������п��淴Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H��0���Իش��������⣺
CO2��g��+H2��g����H��0���Իش��������⣺
������ʼʱc��CO��=2mol��L-1��c��H2O��=3mol��L-1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=____________��
������ͬ�¶��£�����ʼʱc��CO��=1mol��L-1��c��H2O��=2mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬______����ǡ��롰������ʱv������____v���棩������ڡ���С�ڡ����ڡ�����
���𰸡�NO2(g) + CO(g) ![]() NO(g) + CO2(g) ��H= -234 mol��L-1 1.50/t1 mol��L��1��min��1 9 1 �� ��
NO(g) + CO2(g) ��H= -234 mol��L-1 1.50/t1 mol��L��1��min��1 9 1 �� ��
��������
��1����ͼa��֪�÷�Ӧ���ʱ��H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol��
��2����ͼb�����ȼ���v��NO��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��NO2����
��3����ͼb�����ȼ��������ƽ��ʱ��Ũ�ȣ�������ƽ�ⳣ����ʽ����ƽ�ⳣ����
��4��������������Ƚ�������ʽ���������ƽ��ʱ��Ũ�ȣ�������ƽ�ⳣ����ʽ����ƽ�ⳣ����
������������Ƚ�������ʽ��������ʵ�Ũ�ȵõ�Ũ���أ�������Ũ���غ�ƽ�ⳣ������Դ�С�ж�ƽ���ƶ�����
��1����ͼa��֪�÷�Ӧ���ʱ��H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol����CO��NO2��Ӧ���Ȼ�ѧ����ʽΪ��NO2��g��+CO��g��![]() CO2��g��+NO��g����H=-234kJmol-1���ʴ�Ϊ��NO2��g��+CO��g��
CO2��g��+NO��g����H=-234kJmol-1���ʴ�Ϊ��NO2��g��+CO��g��![]() CO2��g��+NO��g����H=-234kJmol-1��
CO2��g��+NO��g����H=-234kJmol-1��
��2����ͼb��֪��t1min����ƽ�⣬ƽ��ʱNO��Ũ�ȱ仯��Ϊ1.5mol/L����v��NO��=![]() =
=![]() molL-1min-1������֮�ȵ��ڻ�ѧ������֮�ȣ���v��NO2��=v��NO��=
molL-1min-1������֮�ȵ��ڻ�ѧ������֮�ȣ���v��NO2��=v��NO��=![]() molL-1min-1���ʴ�Ϊ��
molL-1min-1���ʴ�Ϊ��![]() molL-1min-1��
molL-1min-1��
��3����ͼb��֪��ƽ��ʱCO��NO2��Ũ�Ⱦ�Ϊ0.5mol/L��CO2��NO��Ũ�Ⱦ�Ϊ1.5mol/L����Ӧ��ƽ�ⳣ��K=![]() =
=![]() =9���ʴ�Ϊ��9��
=9���ʴ�Ϊ��9��
��4������������ݿɽ�����������ʽ��
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��mol/L�� 2 3 0 0
�䣨mol/L�� 1.2 1.2 1.2 1.2
ƽ��mol/L�� 0.8 1.8 1.2 1.2
��Ӧ��ƽ�ⳣ��K=![]() =
=![]() =1���ʴ�Ϊ��1��
=1���ʴ�Ϊ��1��
����������ݿɽ�����������ʽ��
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��mol/L�� 1 2 0 0
�䣨mol/L�� 0.5 0.5 0.5 0.5
ĩ��mol/L�� 0.5 1.5 0.5 0.5
���ʱ�÷�Ӧ��Ũ����Qc=![]() =
=![]() =
=![]() ��K=1����ƽ��������Ӧ�����ƶ���v��������v���棩���ʴ�Ϊ������
��K=1����ƽ��������Ӧ�����ƶ���v��������v���棩���ʴ�Ϊ������


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ʵ����������������������泥�(NH4)2SO4��FeSO4��6H2O����һ�ָ���(�ֳ�Ħ����)��һ���������ڿ������ױ������������γɸ��κ�ͱȽ��ȶ�������������һ���������������ˮ�е��ܽ�ȱ��������ÿһ���ε��ܽ�ȶ�С���Ҽ����������Ҵ���������һ���ʿ�����ȡ��������茶��壬�����ε��ܽ��(��λΪg/100gH2O)���±���
�¶ȡ� | FeSO4��7H2O | (NH4)2SO4 | (NH4)2SO4��FeSO4��6H2O |
10 | 20.0 | 73.0 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78.0 | 28.1 |
ʵ����Ʒ��10%Na2CO3��Һ��Feм��3molH2SO4��(NH4)2SO4������ˮ����ˮ�Ҵ���ʵ�鲽��������ͼ��ʾ��
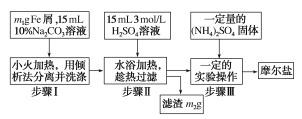
��1����������10%Na2CO3��Һ��������__��
��2����������ʺ�����������__��
A.�����Ŀ����ϴ� B.�������׳��� C.�����ʽ�״ D.��������״
��3��������м���(NH4)2SO4��Ҫ�õ�Ħ���ξ��壬��Ҫ������ʵ�������������������__��__��
��4���õ��ľ�����Ҫ���Ҵ�ϴ�ӵ�Ŀ����__��
��5����֪Ħ���ξ�����100�桫110��ʱ�ֽ⣬�ֽ�IJ����г������⣬�����ܺ���SO3(g)��SO2(g)��N2(g)����ͬѧ����ͼ��ʾװ�����ʵ�飬̽��Ħ���ξ�����ȷֽ�ʱ���ܲ�����������
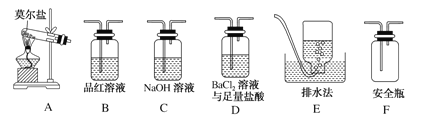
�ټ�ͬѧ��ʵ���У�װ���������ӵĺ���˳��Ϊ��A��F����____________������____________����C��E��
��֤������SO3��ʵ��������__��
��6��Ϊ�ⶨ��������林��ȣ���ȡmgĪ������Ʒ�����500mL��Һ��ͨ���ⶨNH4+���ʵ��װ����ͼ��ʾ��ȡ25.00mL��Ʒ��Һ���и�ʵ�顣
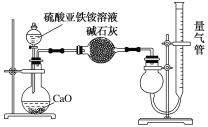
�ٸ÷�����������������Լ���__��
a.ˮ b.����NaHCO3��Һ c.CCl4 d.����ʳ��ˮ
�ڸ÷������ռ������岢�ָ������£�����ǰӦ���еIJ�����__��
�������Ʒ��NH4+��ȫת��ΪNH3�Һ����ܽ���ģ����NH3�����ΪVL��������Ϊ��״���£������Ħ������Ʒ����������林���Ϊ__���ú�m��V�Ĵ���ʽ��ʾ��(NH4)2SO4��FeSO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ӦaA(g)��bB(g)![]() pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
��1���÷�Ӧ���淴Ӧ��________�ȷ�Ӧ����a��b________p(���������������)��
��2����ѹʱ��A����������________(�������С�����䡱����ͬ)������Ӧ����________���淴Ӧ����________��
��3��������B(�������)����A��ת����________��B��ת����________��
��4���������¶ȣ���ƽ��ʱ��B��C��Ũ��֮��![]() ��________��
��________��
��5�������������ƽ��ʱ��������������ʵ���________��
��6����B����ɫ���ʣ�A��C��Ϊ��ɫ���ʣ������A(�������)ʱ��������ɫ________������C(�������)ʱ��������ɫ________����ά�������������ѹǿ���䣬��������ʱ����������ɫ_______(���dz����������䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.���ˮ�еμ�FeCl3��Һ�Ʊ�����: Fe3��+3H2O![]() Fe(OH)3��+3H��
Fe(OH)3��+3H��
B.��H2SO4��Һ�е���Ba(OH)2��Һ����Һ�����ԣ�H��+SO42-+Ba2��+OH��=BaSO4��+H2O
C.����CuSO4��Һ��Ӧ��2Na+Cu2��=Cu +2Na��
D.Ca(HCO3)2��Һ������NaOH��Һ��Ӧ��HCO3����Ca2����OH��=CaCO3����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը��ݱ�ǩ�ϵ��й����ݻش���������

(1)��Ũ��������ʵ���Ũ��Ϊ______mol��L��1��
(2)ȡ����������ĸ�Ũ����ʱ�������������в�����ȡ����Ķ��ٶ��仯����_______(����ĸ����)��
A����Һ��HCl�����ʵ��� B����Һ��Ũ��
C����Һ��Cl������Ŀ D����Һ���ܶ�
(3)ijѧ����������Ũ���������ˮ����480 mL���ʵ���Ũ��Ϊ0.400 mol��L��1��ϡ���ᡣ
�ٸ�ѧ����Ҫ��ȡ_________mL������һλС��������Ũ����������ơ����ʵ������5mL��10mL��50mL��Ͳ��Ӧѡ��___________mL��Ͳ��á�
������ʱ��������������Ͳ���ձ����������⣬����Ҫ�������У�___________��
����������ᵼ��������Һ��Ũ��ƫ�͵���__________(����ĸ����)��
A��Ũ����ӷ���Ũ�Ȳ���
B������ǰ����ƿ����������ˮ
C��������Һʱ����������ƿ�̶���
D����ˮʱ�����̶��ߣ��ý�ͷ�ι�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��ҺW�����������е���������ɣ�H����![]() ��Fe3����Ba2����Mg2����
��Fe3����Ba2����Mg2����![]() ��I����OH����
��I����OH����![]() ����W�м������ۺ�������Y������Ԫ�ص�����X�����ɡ���������ˮ�ĵ��룬������˵������ȷ����
����W�м������ۺ�������Y������Ԫ�ص�����X�����ɡ���������ˮ�ĵ��룬������˵������ȷ����
A.Xһ����Al3��B.Yһ����H2
C.W����ຬ��6������D.��Һ�в����ܺ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���� ( )
A.���ʯ��һ�������к���6��̼ԭ�ӡ�
B.12 gʯī����Ԫ������ĿΪ0.5NA��
C.1���ɱ�����������Ϊ![]() ��44 g��
��44 g��
D.�������������ܶѻ��γɵľ����н�������4������ԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��ǿ����I����Fe2������100 mL�⻯������Һ�л���ͨ��3.36 L(��״��)��������Ӧ��ɺ���Һ����һ���Fe2+��������Fe3+����ԭ�⻯������Һ�����ʵ���Ũ��Ϊ
A. 1.2 mol��L��1 B. 1.5 mol��L��1 C. 1.0 mol��L��1 D. 1.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݻ���Ϊ1L�ļס����������������У��ֱ����2molA��2molB��1molA��1molB����ͬ�����£��������з�Ӧ��A(g)��B(g)![]() xC(g�� ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵������ȷ����
xC(g�� ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵������ȷ����
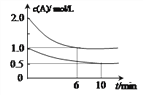
A. x=1
B. �������£��÷�Ӧ��ƽ�ⳣ��K��4
C. �����������¿����̷�Ӧ��ƽ���ʱ�䵫�������ƽ��ת����
D. ������B��ƽ��ת�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com