
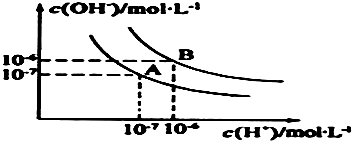
 ˮ�ĵ���ƽ��������ͼ��ʾ��
ˮ�ĵ���ƽ��������ͼ��ʾ������ ��1��ˮ�ĵ��������ȷ�Ӧ�������¶ȴٽ�ˮ�ĵ��룬c��H+����c��OH-��=Kw����ˮ�������Ӻ�����������Ũ����ȣ�
��2��25��ʱ��0.1L 0.1mol��L-1��NaA��Һ��pH=10��˵��NaAΪǿ�������Σ�����Һ�ʼ��ԣ�
��3���������������ҺΪx��������Һ�����Ϊy����������������ʽ��������֮�ȣ�
��4�������Һ�����ԣ�˵�����������ӵ����ʵ������ڼ������������ӵ����ʵ�����
��5������25��ʱpH=2���������ߵ�100��ʱ�����ӻ�����������Һ������������������Ũ�Ȳ��䣬����25��ʱpH=12NaOH���ߵ�100��ʱ����������Ũ�Ȳ���c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-12}}$=10-2mol/L�������ӻ������仯ΪKw=10-12��c��H+��=$\frac{1{0}^{-12}}{1{0}^{-2}}$=10-2mol/L��
��� �⣺��1��ˮ�����ӻ�KW=c��H+��•c��OH-����25��ʱ��KW=c��H+��•c��OH-��=10-7��10-7=10-14��100��ʱ��KW=c��H+��•c��OH-��=10-6��10-6=10-12��ˮ�ĵ���Ϊ���ȷ�Ӧ�������¶ȴٽ�ˮ���룬����ˮ�����ӻ���������
�ʴ�Ϊ��10-14��10-12��ˮ�ĵ���Ϊ���ȷ�Ӧ�������¶ȴٽ�ˮ���룻
��2������0.1L 0.1mo/L��NaA��Һ��pH=10��˵����Һ��ʾ���ԣ�HA����������ʣ�NaA��Һ�������ڵ����ӵ����ʵ���Ũ���ɴ�С��˳��c��Na+����c��A-����c��OH-����c��H+��
�ʴ�Ϊ��c��Na+����c��A-����c��OH-����c��H+����
��3��������������Һ�����ΪxL��������Һ�����ΪyL��pH=11��NaOH��Һ�У����������ӵ�Ũ��Ϊ��10-3mol/L��pH=4��������Һ��������Ũ��Ϊ��10-4mol/L������Ϻ���Һ��pH=9����Һ���Լ��ԣ���Һ�����������ӵ�Ũ��Ϊ10-5mol/L�����������ƹ�����
��10-3mol/L��xL-10-4mol/L��y=10-5mol/L��x+y����
���x��y=1��9��
�ʴ�Ϊ��1��9��
��4����ǿ����Һ��pHΪa�����Ϊ10V����Һ��������Ũ��Ϊ��10-amol/L������Һ��pHΪb�����ΪV����Һ�����������ӵ�Ũ��Ϊ��10-��12-b��mol/L����Ϻ���Һ�����ԣ���������Һ�������ӵ����ʵ����������������ӵ����ʵ�������10-amol/L��10VL=10-��12-b��mol/L��VL��
��ã�1-a=b-12��a+b=13��
�ʴ�Ϊ��a+b=13��
��5������25��ʱpH=2���������ߵ�100��ʱ�����ӻ�����������Һ������������������Ũ�Ȳ���PH=2������25��ʱpH=12NaOH���ߵ�100��ʱ����������Ũ�Ȳ���c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-12}}$=10-2mol/L�������ӻ������仯ΪKw=10-12��c��H+��=$\frac{1{0}^{-12}}{1{0}^{-2}}$=10-10mol/L����ҺPH=10��
�ʴ�Ϊ��2��10��
���� ���⿼����������ʵĵ��룬��ȷ������ʵĵ����ص㼰Ӱ��������ʵ�������أ���Ӧ����Һ����Ե��жϣ�ע�����ӻ��������ĵ�����������Ŀ�Ѷ��еȣ�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������c��b | B�� | ���ӵĻ�ԭ�ԣ�Y2-��Z- | ||
| C�� | �⻯����ȶ��ԣ�H2Y��HZ | D�� | ���Ӱ뾶��cY2-��dZ-��bX+��aW3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1mol C nH 2n+2�������еĹ��ۼ���ĿΪ��3n+1��N A | |
| B�� | 14g ��ϩ�ͱ�ϩ�Ļ�����к���ԭ�ӵ���ĿΪN A | |
| C�� | ��״���£�1 L������ȼ�պ����ɵ���̬����ķ�����Ϊ $\frac{5}{22.4}$NA | |
| D�� | 1.5g ����-CH 3�������еĵ������� N A |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ��ظ��������ĵ缫��Ӧ�ǻ�ԭ��Ӧ | |
| B�� | ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ�� | |
| C�� | ԭ����ڹ���ʱ���������ϲ������Ӿ����·���� | |
| D�� | ԭ��صĵ缫ֻ�������ֲ�ͬ�Ľ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ľṹʽ��CH4 | B�� | ������ķ���ʽCH3CH2Br | ||
| C�� | ��ϩ�Ľṹ��ʽCH2CH2 | D�� | �������ʽ CH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | �����Ʋ� | ��ѧ����ʽ |
| ʾ�� | ������ | H2EO3+4HI�TZ��+2I2+3H2O |
| 1 | ||
| 2 |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4 mol A+2 mol B | B�� | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C�� | 3mol C+1 mol D+1 mol B | D�� | 3 mol C+1 mol D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ���ᷴӦ�Ƶ�dz��ɫ��Һ��Fe+4H++NO3-�TFe3++NO��+2H2O | |
| B�� | ��Ca��ClO�� 2��Һ��ͨ�����CO 2��ȡ�����2ClO-+H2O+CO2�T2HClO+CO32- | |
| C�� | ������KMnO 4��Һ��ͨ��SO 2��2MnO4-+5SO2+4OH -�T2Mn2++5SO42-+2H2O | |
| D�� | ����ͭ��Һ�еμ�����������Һ��Ba2++2OH-+Cu2++SO42-�TBaSO4��+Cu��OH��2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com