
常温下,下列各组离子在指定溶液中一定能大量共存的
是( )
A.0.1 mol·L-1NaOH溶液:K+、Na+、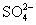 、
、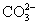
B.0.1 mol·L-1Na2CO3溶液:K+、Ba2+、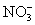 、Cl-
、Cl-
C.0.1 mol·L-1FeCl3溶液:K+、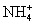 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)= 1×1014的溶液:Ca2+、Na+、ClO-、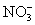
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
某氯化钠样品中混有碘化钠.为获得纯净的氯化钠固体,设计了如下图所示的实验流程:
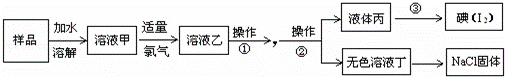
【查阅资料】氯的单质可以置换出碘化物中的碘.
阅读上述实验流程,完成下列填空:
(1)写出溶液甲与氯水发生反应的离子方程式
(2)从“无色溶液丁”中获取氯化钠固体必要的实验操作是:B填序号).
A.蒸馏B.蒸发结晶C.冷却结晶
(3)操作①的名称;所需要的主要试剂是.
(4)操作②的名称;从液体丙获得碘的方法是.
查看答案和解析>>
科目:高中化学 来源: 题型:
300ml 0.01mol/L的FeCl3溶液与200mL 0.06mol/L的KCl溶液中,所含Cl﹣的物质的量浓度之比为()
A. 1:1 B. 1:2 C. 1:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,发生消去反应生成的烯烃只有一种的是( )
①2丁醇 ②2甲基2丙醇
③1丁醇 ④2甲基2丁醇
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知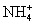 +
+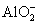 +2H2O====Al(OH)3↓+NH3·H2O,向含有等物质的量的
+2H2O====Al(OH)3↓+NH3·H2O,向含有等物质的量的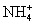 、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
A.H++OH-====H2O
B.Al3++3OH-====Al(OH)3↓
C.Al(OH)3+OH-====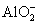 +2H2O
+2H2O
D. 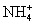 +OH-====NH3·H2O
+OH-====NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 |
|
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为 。
(3)C常用作净水剂,用离子方程式表示其净水原理 。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为 。
(5)向20 mL 2 mol·L-1C溶液中加入30 mL E溶液,充分反应后得到0.78 g沉淀,则E溶液的物质的量浓度可能是 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固体X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1,推测含1mol HCl的稀溶液与含1mol NH3的稀溶液反应放出的热量( )
|
| A. | 小于57.3 kJ | B. | 等于57.3 kJ | C. | 大于57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 |
|
| B. | NH4HCO3(s) |
|
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可单独作为反应自发性的判据 |
|
| D. | 在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com