
【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |

A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
科目:高中化学 来源: 题型:
【题目】课外活动时间玛丽同学制备Fe(OH)3胶体,具体操作如下:首先在烧杯中加入25mL蒸馏水,用酒精灯加热至沸腾,然后向烧杯中逐滴滴加6滴FeCl3饱和溶液,并继续煮沸至液体呈透明的红褐色,即得Fe(OH)3胶体。试回答下列问题:
(1)写出该反应的化学方程式:___。
(2)如何证明玛丽同学是否成功制得胶体_____?
(3)若玛丽同学在滴加FeCl3饱和溶液的同时用玻璃棒不断搅拌,结果没有得到胶体,为什么呢_____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,其摩尔质量为392 g/mol,可溶于水,在100℃~ 110 ℃时分解。为探究其化学组成,甲乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有_____________。
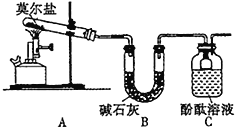
(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:
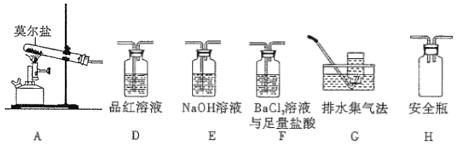
①乙组同学的实验中,装置依次连接的合理顺序为A→H→__________________________→G
②证明含有SO3的实验现象是_______________。
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000molL-1的酸性K2Cr2O7溶液分三次进行滴定。
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。

(1)滴定过程中,酸性K2Cr2O7溶液应装在_____________滴定管中。甲方案中的离子方程式为_________________________________。
(2)乙方案中量气管中最佳试剂是______(填字母)。
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________________________。
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为___________。(用含V、m的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。
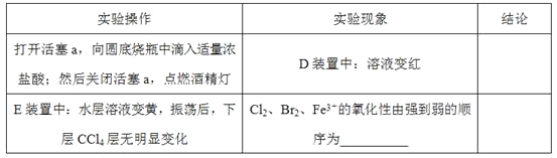
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SDIC是一种性能稳定的高效广谱杀菌消毒剂,广泛用于环境水处理食品加工公共场所等清洁消毒,结构如图甲所示其中WXYRZ均为短周期元素且原子序数依次增大,Z在同周期主族元素中原子半径最小,且Z与Y位于不同周期
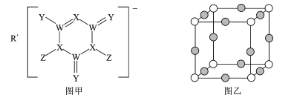
回答下列问题:
(1)SDIC中,电负性最小的元素是____(填元素名称) ,其中W最外层的孤电子对数为__________。
(2)基态X3-的核外电子排布式为____某离子晶体中含有X3-和M+两种离子,其中M+核外电子正好充满KLM3个能层,则M的元素符号是___ ,该晶体晶胞结构如图乙所示,则X3-的配位数为____
(3)X≡X的键能为942kJ/mol,X-X单键的键能为247kJ/mol,则X的最常见单质中____(填“σ”或“π”)键更稳定
(4)X的最简单氢化物是___ 分子(填“极性”或“非极性”),该分子与1个H+结合形成离子时键角___ (填“变大”“变小”或“不变”),原因是____
(5)SDIC的原子发射光谱中呈现特征颜色的微观原因是____
(6)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中已知晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体密度为____g/cm3 (列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
A.v(H2)=0.06mol·L-1·s-1B.v(N2)=0.1mol·L-1·min-1
C.v(N2)=0.2mol·L-1·min-1D.v(NH3)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是

A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com