
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一, 其原理是利用预焙烧破坏铍矿物(绿柱石—3BeO· Al2O3·6SiO2及少量FeO等)的结构与晶型, 再采用硫酸酸解含铍矿物, 使铍、铝、铁等酸溶性金属进入溶液相, 与硅等脉石矿物初步分离, 然后将含铍溶液进行净化、除杂, 最终得到合格的氧化铍( 或氢氧化铍) 产品, 其工艺流程如右图。
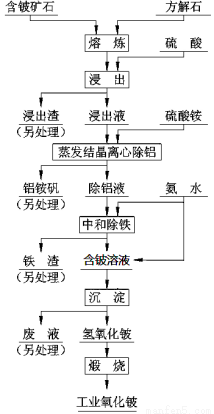
已知:(1)铝铵矾的化学式是NH4Al(SO4)2·12H2O(2)铍元素的化学性质与铝元素相似
根据以上信息回答下列问题:
(1)熔炼物酸浸前通常要进行粉碎,其目的是: ;
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程是_____________________洗涤、过滤。
(3)“中和除铁”过程中“中和”所发生反应的离子方程式是__________________,用平衡原理解释“除铁”的过程_____________________。
(4)加入的“熔剂”除了流程中的方解石外,还可以是纯碱、石灰等。其中, 石灰具有价格与环保优势, 焙烧时配料比( m石灰/ m绿柱石) 通常控制为1:3, 焙烧温度一般为1400℃—1500℃ 。若用纯碱作熔剂,SiO2与之反应的化学方程式是__________________________,若纯碱加入过多则Al2O3、BeO也会发生反应,其中BeO与之反应的化学方程式是_______________________,从而会导致酸浸时消耗更多硫酸,使生产成本升高,结合离子方程式回答成本升高的原因_____________________。
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2016届广东省惠州市高三上学期第二次调研测试化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
下列说法正确的是
A.由水电离出H+的浓度c(H+) :①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5
C.①与③混合,若溶液pH = 7,则体积V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,若溶液pH < 7,各离子浓度的关系为:c(CH3COO-) + c(OH-) = c(Na+) +c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第三次月考化学试卷(解析版) 题型:选择题
将0.2 mol·L-1 HCOOH溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,中学化学常见物质甲、乙存在转化关系,则乙可能是( )

A.Al(OH)3 B.H2SiO3 C.FeCl2 D.CH3C1
查看答案和解析>>
科目:高中化学 来源:2016届湖南省十校共同体高三上学期12月联考化学试卷(解析版) 题型:填空题
NH3是一种重要的化工产品。
(1)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据实验需要,装置可重复选择,加入的NH4 Cl与Ca(OH)2的量足以产生使CuO完全还原为N2的氨气)。

请回答下列问题:
①氨气还原炽热氧化铜的化学方程式为_______________;
②从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的字母表示)A→ ;
③在本实验中,若测得m( CuO) =ag,m(H2O)=b g,则Ar(Cu)= ;
④在本实验中,使测定结果Ar(Cu)偏大的是 (填字母);
A.CuO未完全起反应 B.CuO不干燥
C.CuO中混有不反应的杂质 D.NH4 Cl与Ca(OH)2混合物不干燥
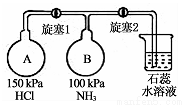
(2)按右图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是 原因是
②稳定后,关闭旋塞1,再打开旋塞2,B瓶中的现象是 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第二次模拟化学试卷(解析版) 题型:选择题
有A、B、C、D四种短周期元素在周期表中位置如图所示。已知:A2+与C原子的电子数相差2。下列推断不正确的是
…… | C | |||
A | B | …… | D |
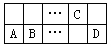
A.A和D组成的化合物是弱电解质且水溶液呈酸性
B.与A同周期且与C同主族的E元素,其最高价氧化物对应水化物在某些化学反应中常作催化剂
C.离子半径:C>A>B
D.B与C形成的化合物是冶金工业的一种原料
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:实验题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
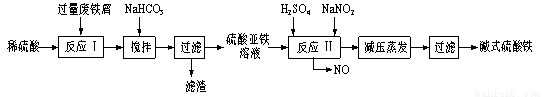
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期第三次月考化学试卷(解析版) 题型:选择题
常温下某溶液中,由水电离出的c(H+)为1×10—12mol/L,该溶液中一定能大量共存的离子组是
A.K+、Na+、SO42—、NO3— B.Na+、K+、ClO—、CO32—
C.Fe2+、Mg2+、Cl—、SO42— D.NH4+、Cl—、K+、SO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com