
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
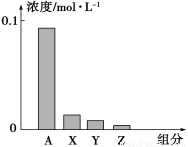
A.HA为强酸
B.图中X表示HA,Y表示OH-,Z表示H+
C.该混合液pH=7
D.该混合溶液中:c(A-)+c(HA)=c (Na+)
D
【解析】
试题分析:A.0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,得到的溶液为0.1mol/L的NaA溶液,若HA为强酸,则溶液为中性,且c(A-)=0.1mol/L,与图不符,所以HA为弱酸,错误;B.酸碱混合得到的溶液为0.1mol/L的NaA溶液,A-水解使溶液显碱性,溶液中的粒子浓度的大小关系是c(Na+)> c(A-)>c(OH-)>c(HA)> c(H+),所以X是OH-,Y是HA,Z表示H+,错误;C.根据上述分析,可知该溶液的pH>7,错误;D.根据物料守恒,有c(A-)+c(HA)=c(Na+),正确;选D。
考点:考查弱电解质的电离特征,溶液酸碱性的判断,离子浓度的比较,图像分析等知识。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源:2014-2015山东省菏泽市高一上学期期末考试化学A试卷(解析版) 题型:选择题
下列分离或提纯物质的方法正确的是
A.用渗析的方法精制Fe(OH)3胶体
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
下列说法或做法正确的是
A.CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性大于碳酸
B.一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是4.6g
C.铝比铁活泼,所以铝比铁更容易被腐蚀
D.正常雨水PH等于7,酸雨的PH小于5.6
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:实验题
(11分)某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量。

(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的_________(填“正极”或“负极”);
(2)电解开始一段时间后,在U形管中可观察到的现象有__________________,电解的离子方程式为___________________________________。
(3)实验中还需测定的数据是_______________(填写序号)
①B极的质量增重m g
②A极的质量增重m g
(4)下列实验操作中必要的是________(填字母)
A.称量电解前电极的质量
B.电解后,取出电极直接烘干称重
C.刮下电解过程中电极上析出的铜,并清洗、称重
D.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为:___________(用含有m、V的计算式表示)
(6)如果用碱性(KOH为电解质)甲醇燃料电池作为电源进行实验,放电时负极电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:选择题
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:选择题
清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。其主要成分都是
A.碳氢化合物 B.碳水化合物 C.氢气 D.醇类
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(15分,请都用字母序号填写,多选、错选均不得分)有下列几种晶体:
A.SiC
B.CO2
C.水晶
D.白磷
E.晶体氩
F.氯化铵
G.金刚石
H.铁
(1)其中经常用作玻璃刀刀头的是
(2)属于原子晶体的化合物是________________________
(3)含有共价键的离子晶体是_________________________
(4)受热熔化后化学键不发生变化的是_________________
(5)熔融状态下能导电的是___________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:填空题
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 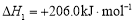
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 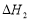
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
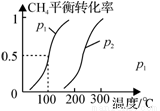
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
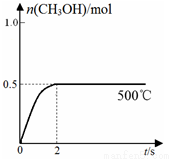
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g) 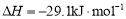 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
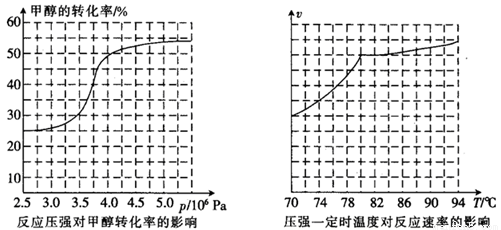
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2 → 2CO2 +3H2O,电池示意如图,下列说法正确的是
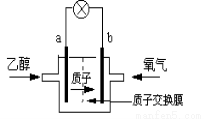
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池负极的电极反应为:4H+ + O2 + 4e- = 2H2O
D.电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com