
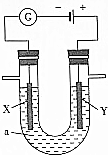
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 (1)电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子发生氧化反应生成氯气,阴极上是氢离子得电子发生还原反应生成氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气;
(2)①用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极是镀层金属,阴极是待镀金属;
②假设粗铜中的杂质只有金一种,电镀过程中溶液体积保持不变,阳极电极反应:Cu-2e-=Cu2+,阴极电极反应:Cu2++2e-=Cu,结合电子守恒分析;
③依据阴极析出的铜质量结合电极反应计算电子转移;粗铜中的杂质只有金一种,并且金的含量为a%,铜为1-a%,结合阴极析出铜的质量计算获得金的质量.
解答 解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,X电极负极水的电离被破坏,氢氧根离子浓度增大,溶液呈红色,当电路中有0.2mol电子通过时,X极产生的气体物质的量为0.1mol,在标准状况下体积=0.1mol×22.4L/mol=2.24L,
故答案为:2H++2e-=H2↑;溶液呈红色;2.24L;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色,
故答案为:用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
③电解饱和食盐水的总化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,$\frac{\underline{\;通电\;}}{\;}$
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)①用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极是镀层金属,阴极是待镀金属,X电极为阴极,电极的材料是精铜,
故答案为:精铜;
②假设粗铜中的杂质只有金一种,电镀过程中溶液体积保持不变,粗铜做阳极,阳极电极反应:Cu-2e-=Cu2+,精铜做阴极,阴极电极反应:Cu2++2e-=Cu,电子守恒可知电解质溶液中CuSO4的浓度不变,
故答案为:不变;粗铜做阳极,含有的金不失电子,只有铜失电子,阴极上溶液中铜离子得到电子生成铜,电子守恒可知溶液中铜离子浓度不变;
③阴极析出的铜质量为bkg,电极反应Cu2++2e-=Cu,
结合电极反应计算电子转移=$\frac{b×1000g}{64g/mol}$×2×NA=$\frac{1000b{N}_{A}}{32}$,
粗铜中的杂质只有金一种,并且金的含量为a%,铜为1-a%,结合阴极析出铜的质量计算获得金的质量设为x,(100-a):a=b:x,解得x=$\frac{ab}{100-a}$kg,
故答案为:$\frac{1000b}{32}$;$\frac{ab}{100-a}$.
点评 本题考查了电解原理的分析应用,主要是电极反应的书写、电子守恒的计算应用、电解精炼原理,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 常温下,28g C2H4含NA个碳碳双键 | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
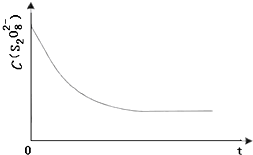 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:| 实验序号 | 体积/mL溶液 | ||||
| K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | V1 | V3 | 4.0 | 2.0 |
| ③ | 8.0 | V2 | V4 | V5 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁是黑色金属,所以断口是黑色的 | B. | 铁是第ⅧB族元素,也是过渡元素 | ||
| C. | 在自然界中无游离态的铁存在 | D. | 自然界里含铁的矿物质叫铁矿石 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
有关电化学说法错误的是
A.1 mol H2和0.5 mol O2反应放出的热量就是H2的燃烧热
B.等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多
C.水中的钢闸门连接电源的负极,属于外加电流的阴极保护法
D.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:实验题
某 校化学研究性学习小组查阅资料了解到以下内容:
校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______________.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去 ,请配平该反应的离子方程式:
,请配平该反应的离子方程式:
______MnO4﹣+______ H2C2O4+______ H+═______ Mn2++______ CO2↑+______ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
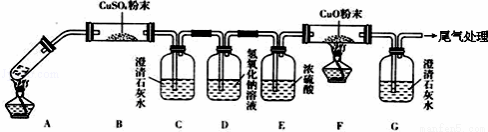
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红 色.据此回答:
色.据此回答:
上述装置中,D的作用是_________.乙二酸分解的化学方程式为_________.只根据G中澄清石灰水变浑浊能否得出“草酸分解产物中一定有CO”的结论_________(填“ 能或不能”)
能或不能”) 若不能应怎样改进?______________.
若不能应怎样改进?______________.
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化).则下列关系合理的是_________
A.c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)
B.c(HC2O4﹣)+c(C2O42﹣)=0.2mol•L ﹣1
﹣1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D.c(Na+)=c(H2C2 O4)+c(HC2O4﹣)+c(C2O42﹣)
O4)+c(HC2O4﹣)+c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 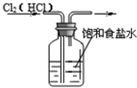 除去氯气中的氯化氢 | B. | 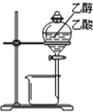 分离乙醇与乙酸 | ||
| C. | 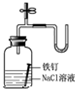 证明铁生锈空气参与反应 | D. | 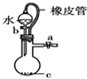 橡皮管的作用是控制水能顺利流下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com