
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
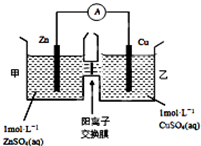 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H16O4 | B. | C14H18O5 | C. | C16H22O5 | D. | C16H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| B. | 1 L 0.1 mol•L-1 CuSO4溶液中含有Cu2+为0.1NA | |
| C. | 2.24 L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学反应中能量变化的主要原因是物质状态的改变 | |
| B. | 铝与盐酸的反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 加入铁触媒做催化剂更有利于工业合成氨 | |
| D. | 锌粒粉碎后与稀硫酸反应产生氢气速度更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
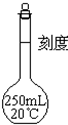 配制250mL 1mol/LNaOH溶液.回答下列问题:
配制250mL 1mol/LNaOH溶液.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com