
【题目】(1)3﹣甲基﹣2﹣丙基﹣1﹣戊烯结构简式为_____________;
(2)丙烯制备聚丙烯化学方程式:__________________;
(3)2-甲基-1,3-丁二烯与Br2的1,4-加成反应化学方程式__________________;
(4)![]() 名称为:_____________;
名称为:_____________;
(5)反-2-丁烯 ___________________________
(6)有机物A只由C,H,O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-O-H和位于分子端的C、H,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1.
①写出A的分子式___________;
②写出A的结构简式___________。
【答案】
 ;
; ![]() +Br2
+Br2![]()
![]() 2,5-二甲基-2,4-己二烯
2,5-二甲基-2,4-己二烯  C5H8O
C5H8O 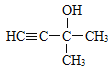
【解析】
(1)3-甲基-2-丙基-1-戊烯的主链含有5个C原子,且含有碳碳双键,支链为甲基、丙基;
(2)丙烯在一定条件下发生加聚反应产生聚丙烯;
(3)二烯烃发生1,4加成时,两个双键同时断裂,在中间的两个碳原子间形成一个新的双键,然后在1、4号C原子上连接两个溴原子;
(4)选择含有2个碳碳双键在内的最长的碳链为主链,将支链当作取代基,给二烯烃命名;
(5)当碳碳双键的两个C原子连接不同的原子或原子团时,就存在空间异构,两个甲基在双键的不同侧时就是反式结构;
(6)①先计算CO2、H2O的物质的量,利用元素守恒计算出C、H的物质的量及质量,用化合物的总质量减去C、H的质量可得O的质量、物质的量,继而可得最简式;然后根据物质结构中含有的H原子的种类及连接方式可得其分子结构简式。
(1)3-甲基-2-丙基-1-戊烯属于烯烃,主链有5个碳原子,碳碳双键在1号、2号C原子之间,在2号C原子上含有1个丙基、在3号C原子上含有1个甲基,该有机物的结构简式为 ;
;
(2)丙烯在一定条件下发生加聚反应,不饱和的碳碳双键中较活泼的键断裂,这些不饱和的C原子彼此连接,形成高聚物,产生聚丙烯,反应方程式为 ;
;
(3)2-甲基-1,3-丁二烯与Br2发生1,4-加成反应时,两个双键同时断裂,在中间的两个碳原子间形成一个新的双键,然后在1、4号C原子上连接两个溴原子,反应的化学方程式为:![]() +Br2
+Br2![]()
![]() ;
;
(4)选择含有2个碳碳双键在内的最长的碳链为主链,将两个甲基当作取代基,由于其结构对称,可以从左端给碳链编号,以确定两个双键和甲基的位置,该物质的名称为2,5-二甲基-2,4-己二烯;
(5)2-丁烯的两个不饱和的碳原子由于连接两个不同的原子,而存在空间异构,反-2-丁烯结构就是CH3、H在双键的同一侧,其结构为 ;
;
(6)①n(C)=n(CO2)=22.0g÷44g/mol=0.5mol,n(H)=2n(H2O)=2(7.2g÷18g/mol)=0.8mol,则8.4g该有机物中含有O原原子的物质的量为n(O)=[8.4g-(0.5mol×12g/mol+0.8mol×1g/mol)]÷16g/mol=0.1mol,n(C):n(H):n(O)=0.5:0.8:0.1=5:8:1,所以最简式为C5H8O;由于质谱图表明其相对分子质量为84,所以其最简式就是分子式。
②由于5个C原子最多可结合12个H原子,化合物A分子只含有8个H原子,说明含有一个碳碳三键,或含有2个碳碳双键。根据红外光谱分析表明A中含有-O-H和位于分子端的C H,核磁共振氢谱显示有3种峰,说明有3种不同位置的H原子,峰面积之比为6:1:1,则3种H原子的个数比为6:1:1,则证明只可能含有1个碳碳三键,可知A的结构为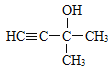 。
。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】下列书写的离子方程式中,正确的是( )。
A. 酸性高锰酸钾溶液与乙二酸(草酸)反应:2MnO![]() +5C2O
+5C2O![]() +16H+===2Mn2++10CO2↑+8H2O
+16H+===2Mn2++10CO2↑+8H2O
B. 在NH4HSO4溶液中缓慢滴入含等物质的量的NaOH的溶液:NH![]() +OH-===NH3·H2O
+OH-===NH3·H2O
C. VO2+与酸性高锰酸钾溶液反应:5VO2++MnO![]() +H2O===5VO
+H2O===5VO![]() +Mn2++2H+
+Mn2++2H+
D. FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2===2Fe3++I2+4Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们祖先的四大发明之一黑火药的爆炸反应为:S+2KNO3+3C![]() A+N2↑+3CO2↑(已配平)。请回答下列问题:
A+N2↑+3CO2↑(已配平)。请回答下列问题:
(1)生成物固体A属于___________晶体,上述化学反应的氧化剂是__________(写化学式);
(2)硫元素在周期表中的位置为_________能说明氯的非金属性比硫强的实验是_______(任写一条即可);
(3)C原子最外层电子的电子排布式是_____,CCl4是一种常见的有机溶剂,写出其电子式_____,判断其属于_________(填“极性”、“非极性”)共价键_____分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的结构可用示意图表示为_______,1 mol该天蓝色微粒所含的σ键数目为________。
(2)加入乙醇的作用是__________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键称为_____,提供空轨道的微粒是_______,提供孤电子对的成键原子是_____,该晶体中配体分子的VSEPR模型为_______。
(5)下列说法正确的是_________
a.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素
b.氨气分子和水分子的空间构型不同,氨气分子的键角大于水分子的键角
c.氨气极易溶于水,是因为氨气分子和水分子之间形成2种不同的氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物性质多样,用途广泛。
完成下列填空。
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2;
2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间内的CO浓度如下表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c (CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
该反应的平衡常数表达式为________;温度升高,K值________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_______________。
(2)工业合成氨的反应温度选择500℃左右的原因是_________________。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___________。
a.N2、H2、NH3的浓度之比为1∶3∶2
b.容器内的压强保持不变
c. N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度有大到小的顺序是____________;在通入NH3的过程中溶液的导电能力________(选填“变大”、“变小”、“几乎不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关 2个电化学装置的叙述正确的是 ( )

A.图I,由于盐桥中的![]() 移向
移向![]() 溶液,一段时间后,使溶液中的正电荷数量增加
溶液,一段时间后,使溶液中的正电荷数量增加
B.图I,在不改变总反应的前提下,可用![]() 替换
替换![]() ,用石墨替换 Cu棒
,用石墨替换 Cu棒
C.图II,通电后![]() 和
和![]() 先从阳极区移动到阴极,然后阴极才发生反应
先从阳极区移动到阴极,然后阴极才发生反应![]()
D.图II,通电后,由于 ![]() 向阳极迁移,导致阳极附近 pH升高
向阳极迁移,导致阳极附近 pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol ClOx-(x=0,1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( )
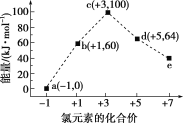
A.e是ClO3-
B.b→a+c反应的活化能为60 kJ·mol-1
C.a、b、c、d、e中c最稳定
D.b→a+d反应的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq) ΔH=-116 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氨气代替氢气来研发氨燃料电池是当前科研的一个热点,氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2![]() 2N2+6H2O。下列有关说法错误的是( )
2N2+6H2O。下列有关说法错误的是( )
A. 燃料电池的能量转化率一般比普通的电池高
B. 氨燃料电池在放电时,负极反应为2NH3-6e-+6OH-===N2+6H2O
C. 以氨气代替氢气的主要原因是氨气易液化、易储存
D. 氨燃料电池在充电时,在阴极N2得电子被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的数值,下列说法中正确的是
表示阿伏加德罗常数的数值,下列说法中正确的是
A. 在常温常压下,11.2L氯气所含的原子数为![]()
B. 2.3g金属钠被氧化成Na2O2,转移电子数为0.1![]()
C. 5.6g铁与足量稀盐酸反应转移的电子数为0.3![]()
D. 2L 0.1 mol/LNa2SO4溶液中含有的Na+的数为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com