
 将总物质的量为4mol的Na2O2和Al2(SO4)3混合物投入足量水中,充分反应后生成ymol沉淀(y≠0).若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值与y=f(x)关系式填写在表内(可填满,也可不填满或补充),并在图中画出函数图象.
将总物质的量为4mol的Na2O2和Al2(SO4)3混合物投入足量水中,充分反应后生成ymol沉淀(y≠0).若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值与y=f(x)关系式填写在表内(可填满,也可不填满或补充),并在图中画出函数图象.| x值 | y=f(x) |
| 0<x≤3 | y=$\frac{2}{3}$x |
| 3<x<3.2 | y=32-10x |
| - | - |
| - | - |
分析 Na2O2和与H2O反应生成的NaOH,恰好与Al2(SO4)3反应时,生成的Al(OH)3沉淀量最大.根据反应式知道此时,n(Na2O2):n[Al2(SO4)3]=3:1,
当n(Na2O2):n[Al2(SO4)3]≤3:1时,NaOH不足(或恰好反应),与Al3+反应生成Al(OH)3,由Na2O2根据Na原子守恒计算NaOH的物质的量,根据OH-守恒由NaOH计算Al(OH)3沉淀的量;
当n(Na2O2):n[Al2(SO4)3]>3:1时,Al的存在有Al(OH)3和AlO2-两种,有XmolNa2O2,则Al2(SO4)3为(4-X)mol,由Na2O2根据Na原子守恒计算NaOH的物质的量,Na2O2和与H2O反应生成的NaOH有两部分作用,(一)与Al3+反应生成Al(OH)3,(二)与Al3+反应生成AlO2-,根据Al原子守恒用X、Y表示出AlO2-,的物质的量,进而表示出上述两部分消耗的NaOH的量,两部分消耗的NaOH的物质的量之和即为Na2O2和与H2O反应生成的NaOH;根据分析画出函数图象.
解答 解:Na2O2为xmol,则Al2(SO4)3为(4-x)mol,
据Na原子守恒得n(NaOH)=2n(Na2O2)=2Xmol,
根据Al原子守恒得n(Al3+)=2n[Al2(SO4)3]=2(4-x)mol,
Na2O2和与H2O反应生成的NaOH,恰好与Al2(SO4)3反应时,生成的Al(OH)3沉淀量最大,所以有n(Al3+):n(NaOH)=1:3,即2(4-x)mol:2Xmol=1:3,解得,X=3,所以(4-x)mol=1mol,即n(Na2O2):n[Al2(SO4)3]=3:1.
当n(Na2O2):n[Al2(SO4)3]≤3:1时,NaOH不足,根据NaOH计算Al(OH)3的量,根据OH-守恒有2x=3y,即y=$\frac{2}{3}$;
由于n(Na2O2):n[Al2(SO4)3]≤3:1,y>0;所以xmol:(4-x)mol≤3:1,$\frac{2}{3}$>0,联立解得:0<x≤3;
当n(Na2O2):n[Al2(SO4)3]>3:1时,Al的存在有Al(OH)3和AlO2-两种,有xmolNa2O2,则Al2(SO4)3为(4-x)mol,
据Na原子守恒得:n(NaOH)=2n(Na2O2)=2xmol,
根据Al原子守恒得:n(AlO2-)=[2(4-x)-y]mol=(8-2x-y)mol,由关系式
Al3+~~3OH-~~Al(OH)3 Al3+~4OH-~~AlO2-
3ymol ymol 4(8-2x-y)mol (8-2x-y)mol
所以:3ymol+4(8-2x-y)mol=2xmol,
解得:y=32-10x,
由于n(Na2O2):n[Al2(SO4)3]>3:1、y>0,所以xmol:(4-x)mol>3:1,32-10x>0,联立解得:3<x<3.2,
根据以上分析可画出函数图象为: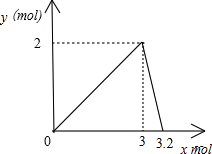 ,
,
故答案为:
| x值 | y=f(x) |
| 0<x≤3 | y=$\frac{2}{3}$x |
| 3<x<3.2 | y=32-10x |
 .
.点评 本题以过氧化钠的性质、铝的化合物性质为载体,考查范围讨论计算,题目难度较大,关键在于明确反应过程,确定恰好反应点,以此分段讨论,试题培养了学生的分析能力及灵活应用能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2n mol AB的同时,生成n mol的B2 | |
| B. | 平衡时容器内的总压强不随时间而变化 | |
| C. | 平衡时容器内各物质的物质的量比为1:1:2 | |
| D. | 单位时间内,生成n mol A2的同时,生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ③⑤ | C. | ②③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 mL,106.0g | B. | 950 mL,100.7g | C. | 950 mL,106.0g | D. | 1000 mL,100.7 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 将1mol Cl2溶解于水中,则溶液中有N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] | |
| C. | 一定条件下,0.1mol H2与足量氮气反应生成NH3,转移电子数为0.2NA | |
| D. | 电解精炼铜,当阳极质量减少3.2g时,电路中通过的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com