
将饱和氯化钠溶液以惰性电极电解一段时间后停止电解,这时剩余的电解液体积为 200mL ,其溶液PH为13,
(1)在标准状况下能收集到的气体体积为 L,
(2)此时转移的电子为 mol。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:阅读理解
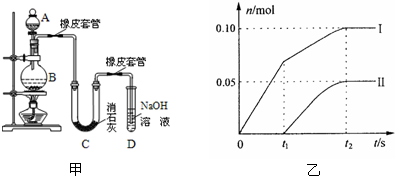
查看答案和解析>>
科目:高中化学 来源: 题型:
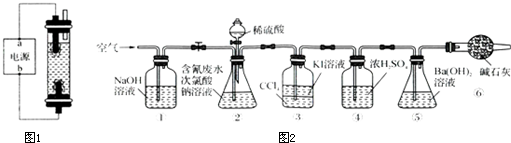

查看答案和解析>>
科目:高中化学 来源: 题型:
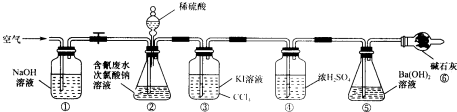
| 实验 | c(H2SO4)mol.L-1 | V(H2SO4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | 100 | 100 | ||
| 2 | 0.0500 | 100 | 100 | |
| 3 | 0.2000 | 100 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)电解时所取饱和氯化钠溶液的质量。
(2)电解后溶液的物质的量浓度。
(3)要使溶液恢复原状态,需要加入多少克什么物质?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com