

| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol•L-1的H2SO4,振荡. | 溶液变蓝色 |
分析 (1)反应中有两种还原产物,其计量数不确定;
(2)加X调节pH时,不能引入杂质,KH(IO3)2与碱反应生成KIO3;
(3)溶液中的氯气与KOH反应生成次氯酸钾,次氯酸钾具有强氧化性;
(4)碘酸钾与碘化钾在酸性条件下单质碘,加四氯化碳,会分层;
(5)根据硫代硫酸钠与碘酸钾的关系式计算碘酸钾的物质的量,再根据质量分数公式计算碘的含量;
(6)酸性条件下,碘离子被氧气氧化生成碘单质;过量的碘离子易被空气氧化生成碘单质.
解答 解:(1)I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑反应中有两种还原产物KCl和Cl2,其计量数不确定,所以方程式配平时,系数有多组;
故答案为:有两种还原产物生成;
(2)加X调节pH时,不能引入杂质,KH(IO3)2与碱反应生成KIO3,所以要加入KOH,其反应的方程式为:KH(IO3)2+KOH=2KIO3+H2O;
故答案为:KOH;KH(IO3)2+KOH=2KIO3+H2O;
(3)溶液中的氯气与KOH反应生成次氯酸钾,次氯酸钾具有强氧化性,KClO能将KIO3氧化成KIO4从而不能得到碘酸钾;
故答案为:反应产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4从而不能得到碘酸钾;
(4)碘酸钾与碘化钾在酸性条件下单质碘,碘单质易溶于四氯化碳,所以用四氯化碳检验碘单质时,混合液分层,下层为四氯化碳层,由于萃取了碘单质,下层液体的颜色为紫红色,
故答案为:液体分层,下层液体呈现紫红色;
(5)设碘酸钾的物质的量为x,根据反应KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O、I2+2S2O3 2-=2I-+S4 O62-可得关系式:KIO3~3I2~6S2O3 2-,
则 KIO3~3I2~6S2O3 2-,
1 6
x 2.0×10-3mol/L×0.01L
x=$\frac{2.0×1{0}^{-3}mol/L×0.01L×1}{6}$=$\frac{1}{3}$×10-5mol,
根据碘原子守恒知,碘元素的质量=$\frac{1}{3}$×10-5mol×127g/mol=$\frac{127}{3}$×10-5mg,
所以碘元素的质量分数为:$\frac{\frac{127}{3}×1{0}^{-5}×1{0}^{3}mg}{w×1{0}^{-3}kg}$×100%=$\frac{1270}{3w}$mg/kg,
故答案为:$\frac{1270}{3w}$;
(6)①酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O;
故答案为:4I-+4H++O2=2I2+2H2O;
②酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,
故答案为:因加入了过量KI溶液,乙实验结果会偏大.
点评 本题考查了碘酸钾的制备、实验操作评价以及有关计算,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.


科目:高中化学 来源: 题型:解答题


 .
. .
. 或
或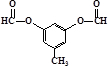 .
. 与G互为同分异构体
与G互为同分异构体查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L三氯甲烷中共价键数目为4NA | |
| B. | 1mol碳烯(:CH2)所含电子总数为8NA | |
| C. | 6.4gCaC2晶体中含有阴阳离子总数为0.2NA | |
| D. | 1 mol CO2与含2 mol NaOH的溶液反应后,溶液中CO32-数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.4 mol/L | C. | 0.5 mol/L | D. | 0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN显血红色的溶液:Na+、NH4+、Cl-、I- | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的NaOH溶液:K+、SiO32-、NO3-、SO42- | |
| D. | 通入足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 随核电荷数增加卤素原子半径增大 | B. | 随核电荷数增加,单质熔沸点升高 | ||
| C. | 随核电荷数增加,单质氧化性增强 | D. | 随核电荷数增加氢化物越来越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ①③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由极性共价键形成的共价化合物.
,它是由极性共价键形成的共价化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com