
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 提纯鸡蛋白中的蛋白质时,可向鸡蛋清溶液中加入浓硫酸铵溶液,然后将所得沉淀滤出,经洗涤即得到较纯净的蛋白质 | |
| D. | 石油分馏是化学变化,而煤的干馏为物理变化 |
分析 A.葡萄糖为单糖;
B.油脂中油为不饱和高级脂肪酸生成的酯;
C.加入浓硫酸铵溶液,蛋白质发生盐析,为可逆过程;
D.煤的干馏是煤在隔绝空气的条件下发生的复杂物理、化学变化.
解答 解:A.葡萄糖为单糖,不能水解,而纤维素、葡萄糖和脂肪在一定条件下都可发生水解反应,故A错误;
B.油脂中油为不饱和高级脂肪酸生成的酯,可使溴的四氯化碳溶液褪色,故B错误;
C.浓硫酸铵溶液能使蛋白质发生盐析而沉淀,将所得沉淀滤出,经洗涤即得到较纯净的蛋白质,故C正确;
D.石油分馏为物理变化,而煤的干馏为煤在隔绝空气条件下发生复杂的物理化学变化,故D错误;
故选C.
点评 本题考查较综合,涉及有机物的结构与性质、物质的分离提纯以及化学变化等,注意油脂中包含油、脂两类,注重基础知识的考查,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 久置的氯水中已没有分子,只有离子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
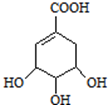 ,如图是以莽草酸A为原料的有机合成路线.
,如图是以莽草酸A为原料的有机合成路线.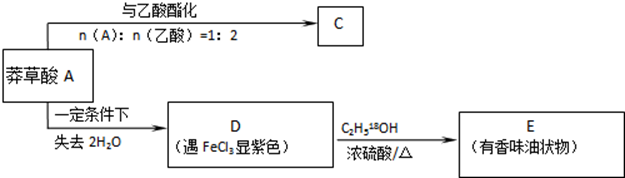
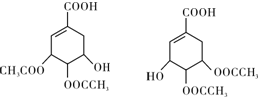
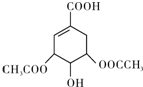 (任写一种).
(任写一种). .
.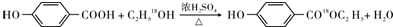 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
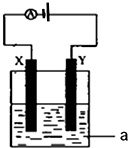 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的液氯能用钢瓶贮存 | B. | 氯气和液氯是两种不同的物质 | ||
| C. | 可以用浓硫酸除去氯气中的水蒸气 | D. | 氯气曾在战争中被用于制造毒气弹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com