
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是

A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将200mL0.01mol/LNaOH与50mL某浓度的Ca (OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是0.016mol/L,则Ca(OH)2溶液的物质的量浓度是mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。水中溶解氧的测定步骤如下:
(1)向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;
(2)加入适量稀H2SO4,搅拌,等MnO(OH)2与I-完全反应生成Mn2+和I2后;
(3)用Na2S2O3标准溶液滴定至终点。
测定过程中物质的转化关系如下:
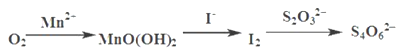
已知:MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O 2S2O32- +I2= S4O62-+2I-
①加入稀硫酸后搅拌的作用是__________;Na2S2O3标准溶液应装在______________滴定管中(填酸式或碱式)。
②滴定过程中以_____________为指示剂;达到滴定终点的标志为____________________。
③写出O2将Mn2+氧化成MnO(OH)2的离子方程式____________________;
④若加入的稀H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差。写出产生误差的一个原因(用离子方程式表示)__________________。
⑤下列操作使测得水样中溶氧量(DO)比实际值偏高的是__________________。
A.第(1)步操作静置时没有密封 B.装Na2S2O3标准溶液的滴定管没有润洗
C.滴定前锥形瓶洗净后没有干燥 D.滴定前读数正确,滴定后俯视读数
⑥取加过一定量CaO2·8H2O的池塘水样l00.00mL,按上述方法测定水中溶解氧量,消耗0.01000
mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为____________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种有机光电材料中间体,由A制备F的一种合成路线如下:

已知:![]()
回答下列问题:
(1)A的结构简式为________,C的化学名称是______。
(2)①、③的反应类型分别是______、_______。
(3)②的反应条件是_______,有机物X的结构简式为____________。
(4)反应⑤的化学方程式为___________________。
(5)芳香化合物H是D的同分异构体,满足下列条件的同分异构体共有____种;
a.能发生银镜反应 b.含有—C≡CH结构 c.无—C≡C—O—结构
写出其中核磁共振氢谱峰面积比为1:2:2:1的一种有机物的结构简式_______。
(6)写出由1-丁炔和乙炔为原料制取化合物 的合成略线(其他试剂任选)_____。
的合成略线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列电解质溶液,有关叙述正确的是( )
A. 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大
B. NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸
C. Na2SO4溶液在电解过程中,阴极区pH值降低
D. 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是( )
CH3OH(g) 达到平衡。下列说法正确的是( )
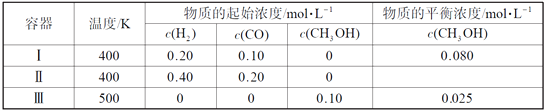
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持洁净安全的生存环境已成为全人类的共识。
(1)家庭装修所用的复合板材中常会放出对人体有严重危害的物质,这种有害物质主要是指________(填名称)。
(2)天然水中含有的细小悬浮颗粒可以用明矾做进行净化处理,明矾水解得到的________可以吸附细小悬浮颗粒。
(3)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.为控制大气中二氧化硫的排放,常采取的措施是在煤炭中加入石灰石粉末对化石燃料进行脱硫处理,其原理用方程式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在我国使用最早的合金是________,目前用量最大,用途最广泛的合金是________.
(2)0.5mol H2O 的质量为________g,共有________个原子.
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是________;在相同的温度和压强下,体积最大的是________.
(4)配制100mL 0.2mol/L CuSO4溶液,需要CuSO45H2O________g.
(5)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因________(用离子方程式表示)
(6)过氧化钠跟水反应的化学方程式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com