
| A. |  | B. | 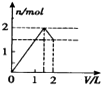 | C. | 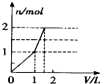 | D. | 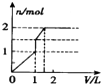 |
分析 HCl和MgSO4溶液存在H+、Mg2+和SO42-离子,加入Ba(OH)2溶液,首先发生Ba2++SO42-=BaSO4↓、H++OH-=H2O,然后发生Mg2++2OH-=Mg(OH)2↓,结合物质的量的关系分析.
解答 解:向含 l mol HCl和l mol MgSO4的混合溶液中加入1mol•L-1 Ba(OH)2溶液,首先发生Ba2++SO42-=BaSO4↓、H++OH-=H2O,当加入0.5L氢氧化钡时,盐酸全部反应,生成0.5mol硫酸钡沉淀,继续加氢氧化钡,发生Ba2++SO42-=BaSO4↓、Mg2++2OH-=Mg(OH)2↓,当加入氢氧化钡体积为1L时,硫酸根离子完全反应,生成0.5mol硫酸钡沉淀和0.5mol氢氧化镁沉淀,再加0.5L氢氧化钡时,镁离子完全沉淀,又生成0.5mol氢氧化镁沉淀,所以需要氢氧化钡共1.5L,图象A符合.
故选A.
点评 本题考查离子反应问题,题目难度中等,注意把握离子反应的先后顺序为解答该题的关键,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有4种官能团 | |
| B. | 分子式为C10H8O6 | |
| C. | 1mol分枝酸最多可与2mol乙醇发生酯化反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 括号内为杂项 | 除杂试剂 | 除杂操作 | |
| A | Na2O2(Na2O) | O2 | 在纯氧中加热 |
| B | Na2CO3(NaHCO3) | CO2 | 通入过量的CO2 |
| C | FeCl(FeCl2) | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4) | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
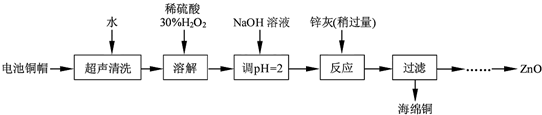
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色 | B. | 乙醇与浓硫酸共热至170℃ | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 在液溴与苯的混合物中撒入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com